Formats des paquets (4)
| code | format d’emballage | prix par unité | prix de boîte par unité | |
|---|---|---|---|---|
| Code et emballage | Prix par pièce | |||

|
code
258462.0955
|
format d’emballage
50x20 ml
|
prix par unité
simple
153,80€
|
prix de boîte par unité
|

|
code
258462.0961
|
format d’emballage
50x40 ml
|
prix par unité
simple
164,00€
|
prix de boîte par unité
|

|
code
258462.0962
|
format d’emballage
50x30 ml
|
prix par unité
simple
158,90€
|
prix de boîte par unité
|

|
code
258462.1255
|
format d’emballage
11x20 ml
|
prix par unité
simple
33,85€
|
prix de boîte par unité
|
Données techniques
- Density:
- 1.019 kg/l
- Solubility:
- Miscible with water
- Physical Description:
- liquid
- Product Code:
- 258462
- Product Name:
- Histofix®-Safe Preservative ready to use (CE-IVD) for clinical diagnostics
- Quality Name:
- for clinical diagnostics
- Headline Comment:
- In Vitro Diagnostic medical device class A in compliance to the Regulation (EU) 2017/746
- Specifications:
- Assay (Iodom.): 3.7-4.0 %
pH: 6.8-7.2
Methanol (w/v): 1 - 1.5 %
- Pictogrammes de danger
-
- Storage:
- Room Temperature.
- Signal Word:
- Danger
- GHS Symbols:
- GHS08
GHS07
- H Phrases:
- H350
H317
H341
H302
- P Phrases:
- P201
P202
P261
P272
P280
P281
P302+P352
P308+P313
P321
P333+P313
P363
P405
P501
- Master Name:
- Histofix®-Safe Preservative ready to use
- CS:
- 38229000
Documents
Demande d’information
Comments
HistologieL'histologie est le domaine de la biologie qui étudie la composition, la structure et les caractéristiques des tissus organiques des êtres vivants. L'histologie est étroitement liée à l'anatomie microscopique.
L’histologie ne s'arrête pas aux tissus, mais va au-delà, en observant également les cellules et les autres corpuscules, et est liée à la biochimie, à la cytologie et à la médecine.
L'histologie est importante en médecine et en biologie, se situant à l'intersection de la biochimie, de la biologie moléculaire et de la physiologie, d'une part, et des processus pathologiques et de leurs conséquences, d'autre part.
Les techniques classiques d'histologie sont appliquées dans les laboratoires médicaux pour le diagnostic.
Lorsque le diagnostic avec ces techniques classiques d’histologie n’est pas posé ou nécessite des confirmations, des méthodes complémentaires sont utilisées. Ces techniques comprennent les colorations histochimiques, les méthodes immunohistochimiques, l'hybridation de l'ADN, l'hybridation in situ en fluorescence (FISH), la PCR, la cytométrie de flux et autres.
Les produits de la marque PanReac AppliChem sont destinés aux :
• Laboratoires médicaux : Produits de microscopie.
• Laboratoires de recherche : Produits de génomique, protéomique et de culture cellulaire.
Les laboratoires médicaux
Les laboratoires médicaux peuvent être classés en fonction du type de contrôle effectué.
• Les laboratoires hospitaliers et cliniques : laboratoires intégrés dans un hôpital/clinique pour effectuer des tests sur les échantillons des patients. 4 types de laboratoires sont présents :
• Les laboratoires de pathologie clinique : hématologie, histopathologie, cytologie, pathologie de routine.
• Les laboratoires de microbiologie clinique : bactériologie, mycobactériologie, virologie, mycologie, parasitologie, immunologie, sérologie.
• Laboratoires de biochimie clinique : analyses biochimiques, dosages hormonaux, etc.
• Laboratoire de diagnostic moléculaire ou laboratoire de cytogénétique et de biologie moléculaire.
• Laboratoires d’analyses cliniques externes : ces laboratoires effectuent des tests de routine complétés par des tests spécialisés.
ITW Reagents propose une gamme complète de produits pour l'histologie sous la marque PanReac AppliChem La gamme comprend les réactifs communément utilisés pour la préparation des échantillons pour l'examen microscopique. Cette gamme couvre les étapes de fixation, de nettoyage, d’inclusion en paraffine, de la coloration et du montage. La gamme des réactifs d’histologie ITW est complétée par des produits spécifiques pour les essais complémentaires que soit en génomique, protéomique et/ou culture cellulaire.
De nombreux produits de la marque PanReac AppliChem utilisés en microscopie portent le marquage CE IVD, conformément au nouveau règlement européen (UE) 2017/746 sur les produits de diagnostic in vitro (IVDR).
Techniques et étapes du traitement histologique
Bien que la plupart des étapes du traitement histologique soient communes, certaines d'entre elles sont propres à un seul type de traitement d'échantillon. Par exemple, l'enrobage n'est effectué que sur les tissus et la fixation thermique que sur les échantillons de sang.
Techniques et étapes du traitement histologique
Les étapes les plus courantes et les produits utilisés sont les suivants :
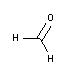
• La fixation : La fixation interrompt les processus de dégradation se produisant après la biopsie. L’étape de fixation a pour objectif de préserver l'architecture et la composition des tissus/cellules aussi proche que possible de ce qu'elles étaient dans l'organisme vivant. La fixation la plus courante est la fixation chimique avec du Formaldéhyde 3,7-4,0% p/v tamponné à pH=7 et stabilisé avec du méthanol. Des formats en petits volumes sont proposés pour une sécurité accrue, dont le conservateur Histofix® Formaldéhyde en dose unique prêt à l'emploi.
• Déshydratation et clarification : Le but est d’éliminer l’eau des tissus et de la remplacer par un milieu qui se solidifie pour permettre la réalisation de coupes fines (4 à 6µm). Pour cela, le tissu biologique doit être inclus dans une matrice dure (paraffine). Les principales étapes de ce processus sont la déshydratation, la clarification et l’imprégnation.
• Déshydratation : Les échantillons fixés dans des solutions aqueuses ne peuvent être imprégnés en paraffine directement. L’eau des tissus doit être éliminée par déshydratation dans une succession de bains d’éthanol de concentration croissante (70%, 95% à 100%).
• Clarification : Bien que le tissu soit maintenant essentiellement exempt d’eau, il ne peut toujours pas être imprégné dans la paraffine car celle-ci est non miscible dans l’éthanol. Il faut utiliser un solvant intermédiaire miscible à la fois dans l’éthanol et dans la paraffine. L’agent de clarification le plus couramment utilisé est le xylène.
• Inclusion ou Imprégnation : par inclusion, l'eau contenue dans le tissu est remplacée par un milieu liquide capable de se solidifier dans des conditions de température appropriées. On utilise à cet effet la paraffine P.F. 55-58°C plastifiée + DMSO en lentilles ou simplement la paraffine P.F. 56-58°C en lentilles.
• Découpage : Les tissus inclus dans la paraffine sont coupés assez finement (4-6 microns) pour permettre à la lumière de les traverser afin de les examiner au microscope. Cette opération est réalisée à l'aide d'un microtome : un instrument mécanique utilisé pour réaliser des coupes micrométriques de tissus. Nous recommandons notre nettoyant pour paraffine afin de garder le microtome propre.
• Déparaffinage-Hydratation : Le déparaffinage-hydratation est le processus qui consiste à retirer le milieu d'enrobage des sections de tissu enrobées de paraffine et à les réhydrater pour une bonne pénétration des colorants. Les réactifs les plus courants à ce stade sont les alcools tels que l'éthanol absolu, l'éthanol 96%, l'éthanol 70% qui peuvent être dénaturés ou non, ainsi que le xylène.
• Coloration : La plupart des tissus, surtout ceux d'origine animale, sont incolores à moins qu'ils ne contiennent un pigment. Il est donc nécessaire de les colorer pour une observation microscopique. Pour ce faire, on utilise des colorants, substances qui, au contact d'un support adéquat, s'y fixent de façon durable en transmettant sa couleur. Les colorants les plus utilisés sont l'hématoxyline et l'éosine, mais il existe une grande variété de colorants en fonction du tissu à colorer.
• Montage et immersion : Une fois que les préparations ont été rincées, elles doivent être montées définitivement. Les agents de montage peuvent être aqueux ou non aqueux ; le type utilisé dépend du protocole concerné. Des exemples de milieux de montage sont DPX, Canada Balsam et Eukitt®. Les milieux d'immersion sont des liquides, souvent des huiles naturelles, qui ont un indice de réfraction défini. Il est important que l'indice de réfraction soit d'environ 1,5 (même indice que le verre). Cela permet une immersion homogène dans l'huile. On utilise à cet effet l'huile d'immersion ou l'huile de cèdre.
• Analyse microscopique : Il s'agit de la phase d'observation microscopique. Aucun réactif supplémentaire n'est nécessaire.
Bien que la plupart des étapes du traitement histologique soient communes, certaines d'entre elles sont propres à un seul type de traitement d'échantillon. Par exemple, l'enrobage n'est effectué que sur les tissus et la fixation thermique que sur les échantillons de sang.
FAQs
Qu'est-ce que l'histologie ?
L'histologie est une discipline de la biologie/médecine qui étudie la composition, la structure et les caractéristiques des tissus organiques des êtres vivants. L'histologie est étroitement liée à l'anatomie microscopique, car son étude ne s'arrête pas aux tissus, mais va au-delà, en observant également les cellules à l'intérieur et les autres corpuscules, en relation avec la biochimie et la cytologie.Qu'entend-on par fixation en histologie ?
Dans le domaine de l'histologie, de la pathologie et de la biologie cellulaire, la fixation consiste à préserver les tissus biologiques de la détérioration par autolyse ou putréfaction. Elle permet d'arrêter toute réaction biochimique en cours et peut également augmenter la résistance mécanique ou la stabilité du tissu traité. La fixation des tissus est une étape fondamentale dans la préparation des coupes histologiques. L'objectif global de la fixation est de préserver les cellules et les composants des tissus de manière à pouvoir produire des coupes fines et colorées. Cela permet d'étudier la structure des tissus, qui est déterminée par la forme et la taille des macromolécules (à l'intérieur et autour des cellules) telles que les protéines et les acides nucléiques.Qu'entend-on par autolyse?
La destruction des cellules ou des tissus par leurs propres enzymes, en particulier celles libérées par les lysosomes, est appelée autolyse.Qu'entend-on par putréfaction?
La putréfaction est la décomposition de la matière organique, en particulier la division typiquement anaérobie des protéines par les bactéries et les champignons, avec la formation de produits malodorants incomplètement oxydés. Le processus de putréfaction est déclenché par les bactéries présentes dans l'environnement. Ces bactéries décomposent la matière organique et produisent des déchets, tels que le méthane et l'ammoniac. Ces gaz font gonfler l'objet et dégagent une odeur nauséabonde.Qu'est-ce qu'un milieu d'infiltration tissulaire ?
Un milieu d'infiltration tissulaire est une formulation spéciale de paraffine purifiée et de polymères plastiques pour l'infiltration ou l'inclusion de l'échantillon biologique.Comment puis-je éliminer l'eau d'un échantillon de tissu ou d'une biopsie ?
Ce processus est généralement réalisé en immergeant les échantillons dans une série de solutions d'éthanol (alcool) de concentration croissante jusqu'à ce que l'on obtienne de l'alcool pur sans eau. L'éthanol est miscible avec l'eau dans toutes les proportions, de sorte que l'eau contenue dans l'échantillon est progressivement remplacée par l'alcool.Quels solvants puis-je utiliser pour éliminer l'eau dans les échantillons de tissus/biopsies en histologie/pathologie ?
L'éthanol absolu, l'éthanol 96 %, l'éthanol 70 % sont les solvants les plus couramment utilisés. La paraffine fondue étant hydrophobe (non miscible à l'eau), la majeure partie de l'eau contenue dans un échantillon doit être éliminée avant qu'il puisse être infiltré dans la paraffine. Ce processus est généralement réalisé en immergeant les échantillons dans une série de solutions d'éthanol (alcool) de concentration croissante jusqu'à ce que l'on obtienne de l'alcool pur sans eau. L'éthanol est miscible avec l'eau dans toutes les proportions, de sorte que l'eau contenue dans l'échantillon est progressivement remplacée par l'alcool. Une série de concentrations croissantes d'alcool est utilisée pour éviter une détérioration excessive du tissu.Qu'entend-on par série de déshydratation graduelle dans la préparation des biopsies histologiques ?
La déshydratation est le processus d'élimination complète de l'eau du tissu fixé. Des concentrations graduelles d'éthanol sont utilisées pour la déshydratation ; le tissu est immergé dans de l'éthanol à 70 % dans de l'eau, puis dans des solutions à 96 % et à 100 %. L'éthanol assure une déshydratation totale, ce qui en fait le réactif de choix pour le traitement des échantillons de microscopie électronique. Pour les tissus délicats, il est recommandé de commencer le traitement dans de l'éthanol à 30 %. Les dessiccants doivent être solubles dans l'eau et l'éthanol est l'agent déshydratant le plus utilisé. L'éthanol possède plusieurs propriétés particulières pour la déshydratation : miscibilité complète avec l'eau, effet de durcissement, pouvoir de déshydratation élevé et perméabilité des tissus. Pour éviter une rigidité excessive des tissus, il est généralement nécessaire d'utiliser de l'éthanol graduel (généralement à des concentrations successives de 70 %, 80 %, 95 % et de l'éthanol absolu) pour remplacer progressivement l'eau dans les tissus. L'isopropanol peut également être utilisé pour remplacer l'éthanol, mais en modifiant le protocole de déshydratation standard. En fonction de la taille ou du type des échantillons, il faut optimiser le temps passé dans l'isopropanol gradué. Les très petits échantillons peuvent surdurcir, et les échantillons gras ou plus grands nécessiteront une déshydratation plus longue. L'isopropanol ne se mélange pas à la paraffine, il faut donc utiliser un agent de clarification comme le xylène.Qu'est-ce que la microscopie à fond clair ?
La microscopie à fond clair (BF) est la plus simple des méthodes d'illumination en microscopie optique. L'échantillon est transilluminé en lumière blanche (c'est-à-dire éclairé par le bas et vu par le haut) et le contraste de l'échantillon est dû à l'atténuation de la lumière transmise dans les zones denses de l'échantillon. La microscopie à fond clair est la plus simple des techniques utilisées pour éclairer les échantillons dans les microscopes optiques, et sa simplicité en fait une technique très populaire. L'aspect typique d'une image de microscopie à fond clair est celui d'un échantillon sombre sur un fond clair, d'où son nom.Qu'entend-on par déshydratation en histologie?
La déshydratation est le processus d'élimination complète de l'eau des tissus fixés. Des concentrations graduelles d'éthanol sont utilisées pour la déshydratation ; le tissu est immergé dans de l'éthanol à 70 % dans de l'eau, puis dans des solutions à 96 % et à 100 %. La plupart des milieux d'infiltration (la matrice de support solide pour la coupe des échantillons de tissus) sont hydrophobes, de sorte que l'eau doit être éliminée des tissus avant tout traitement ultérieur. Il existe deux méthodes générales de déshydratation des tissus. La méthode la plus courante consiste à remplacer progressivement l'eau par un solvant organique en transportant le tissu dans des solutions de concentration croissante (éthanol, acétone) - c'est ce qu'on appelle une série de déshydratation graduelle. Une méthode moins courante en microscopie à fond clair est la déshydratation rapide avec un réactif organique (acétate de 2-méthoxyéthyle, diméthoxypropane, phosphate de triéthyle). La déshydratation rapide remplace rapidement l'eau dans le tissu sans endommager la tension superficielle, comme cela peut être le cas avec les alcools ou l'acétone. L'acétate de 2-méthoxyéthyle et le diméthoxypropane possèdent des régions hydrophiles et hydrophobes. Cela permet au solvant d'interagir avec les lipides des membranes biologiques sans les détruire. La déshydratation qui en résulte se produit par un mécanisme de flux de masse plutôt que par une réaction chimique. L'avantage relatif de chaque méthode est subjectif et dépend des tissus concernés et des préférences personnelles. Dans le passé, la déshydratation rapide était limitée aux procédures d'infiltration plastique, mais elle peut certainement être utilisée avec les techniques de paraffine.Qu'entend-on par coloration en histologie ?
Une coloration ou un colorant est une aide utilisée en microscopie pour améliorer le contraste de l'image vue au microscope. Les colorants sont des substances couramment utilisées en biologie et en médecine pour mettre en évidence les structures des tissus biologiques qui doivent être observées à l'aide de différents types de microscopes. Différents colorants peuvent être utilisés pour augmenter la netteté et examiner de grandes sections de tissu (par exemple, mettre en évidence des fibres musculaires ou du tissu conjonctif), pour mettre en évidence des populations de cellules (par exemple, trier différentes cellules sanguines) ou même pour mettre en évidence des organites à l'intérieur de cellules individuelles. En biochimie, il s'agit d'ajouter un colorant spécifique (qui se lie sélectivement à l'ADN, aux protéines, aux lipides, aux glucides, etc.) à un substrat pour qualifier ou quantifier la présence d'un composé particulier. La coloration et le marquage fluorescent peuvent servir le même objectif. Différents types de colorants biologiques sont également utilisés pour marquer les cellules en cytométrie de flux et pour marquer les protéines ou les acides nucléiques dans l'électrophorèse sur gel.Quels sont les types de coloration en histopathologie ?
Il existe différents types de colorations en fonction du type de diagnostic : hématoxyline et éosine, coloration de Gram, coloration de Giemsa, réaction périodique de Schiff, trichrome de Masson, rouge Congo, bleu de Prusse, mucicarmine, huile noire du Soudan, rouge O, coloration à l'argent, coloration de Nissl, coloration de Papanicolaou, etc.Quelle est la méthode de coloration la plus courante?
Hématoxyline et éosine (H & E) : coloration de routine. Il s'agit de la coloration histologique la plus courante, utilisée pour différencier les différentes structures tissulaires. Elle joue également un rôle important dans le diagnostic de diverses pathologies.Qu'entend-on par "éclaircissement" en histologie ?
Le nettoyage est une étape essentielle du traitement histopathologique en microscopie optique. Le nettoyage a pour but d'éliminer les agents déshydratants (éthanol) des tissus et de préparer les tissus à l'imprégnation avec l'agent d'enrobage (paraffine). Le xylène est l'agent de nettoyage le plus utilisé dans le monde.Qu'est-ce qu'une biopsie ?
Une biopsie est un échantillon de tissu prélevé sur le corps en vue d'un examen plus approfondi. Un médecin recommande une biopsie lorsqu'un premier test indique qu'une zone de tissu dans le corps n'est pas normale. Les médecins appellent une zone de tissu anormal une lésion, une tumeur ou une masse. Ces termes généraux soulignent la nature inconnue du tissu. La zone suspecte peut être découverte lors d'un examen physique ou en interne lors d'un examen d'imagerie.Qu'est-ce qu'un échantillon biologique en histologie ?
En histologie, un échantillon biologique est un matériau tel que l'urine, le sang, les tissus, les cellules, l'ADN, l'ARN ou les protéines provenant d'humains, d'animaux ou de plantes. Les échantillons biologiques sont utilisés pour des tests en laboratoire ou stockés dans un dépôt biologique pour être utilisés dans la recherche.Quel est le flux de travail habituel en histologie ?
Le flux de travail commun dans le laboratoire d'histologie comprend les principales étapes par lesquelles passe un échantillon biologique ou une biopsie, depuis le prélèvement de l'échantillon jusqu'à l'examen au microscope. Ce flux de travail comprend les étapes suivantes : la fixation, le séchage, la clarification, la coloration, l'encastrement et le montage.Quelles sont les colorations utilisées en histologie ?
Les colorations les plus courantes en histologie sont les suivantes : Les colorations de routine : Hématoxyline et éosine ; colorations spéciales : Van Gieson, Bleu de Toluidine, Bleu d'Alcian, Giemsa, Réticuline, Nissl, Orcéine, Noir Soudan B. Trichrome de Masson, Trichrome de Mallory, Trichrome d'Azan, Trichrome de Cason, Acide périodique de Schiff, Résorcine de Weigert et Fuchsine.Comment fixer une biopsie?
Une biopsie peut être fixée avec du formaldéhyde ou du formol. Ce processus est appelé fixation. Le but du formaldéhyde ou du formol est de fixer le tissu pour arrêter les changements autolytiques dans les biopsies. Tous les échantillons doivent être placés immédiatement après l'excision dans du formol tamponné neutre à 10 % afin de les "fixer". Idéalement, la quantité de fixateur doit être au moins dix fois supérieure au volume de l'échantillon.Quelle est la différence entre le formaldéhyde et le formol?
Le formaldéhyde est un gaz incolore, soluble dans l'eau, inflammable à température ambiante et dégageant une odeur forte et irritante. En revanche, le formol est un liquide, qui est préparé en mélangeant le gaz formaldéhyde et l'eau. C'est la principale différence entre le formol et le formaldéhyde. En général, une solution saturée de formol contient environ 40 % (en volume) ou 37 % (en poids) de formaldéhyde gazeux et un stabilisateur pour empêcher la polymérisation du formaldéhyde.Le formaldéhyde est-il cancérigène ?
Le formaldéhyde est l'une des substances les mieux évaluées. En 2014, le formaldéhyde a été reclassé dans la catégorie 1B des substances cancérogènes. La nouvelle classification est entrée en vigueur en juin 2014 lors de sa publication au Journal officiel de l'Union européenne (RÈGLEMENT (UE) No 605/2014 DE LA COMMISSION du 5 juin 2014).Pourquoi l'éthanol est-il utilisé en histologie ?
En histologie, l'éthanol est utilisé comme agent de déshydratation et de réhydratation. La déshydratation sert à préparer le spécimen à être inclus dans la paraffine et à enlever la paraffine avec l'utilisation du xylène comme solvant intermédiaire. Le xylène n'est pas miscible avec l'eau. L'éthanol 96% contient un peu d'eau. Par conséquent, l'éthanol absolu doit être utilisé comme "pont" entre le xylène et l'éthanol à 96%.Pourquoi le xylène est-il utilisé en histologie ?
En histologie, le xylène est utilisé pour le traitement et la coloration des tissus. Le xylène est préféré pour le traitement des tissus parce qu'il les rend transparents, ce qui permet à la paraffine de les recouvrir complètement. Lors de la préparation des lames pour la microscopie, le xylène peut éliminer tout résidu de paraffine des lames.Qu'est-ce que la technique de la paraffine ?
En histologie et en pathologie, la technique de la paraffine permet de fixer et d'incorporer des biopsies dans de la cire. Cela rend le tissu dur et beaucoup plus facile à découper au microtome. Les coupes sont ensuite colorées et examinées au microscope optique.Que signifie Histofix® ?
Histofix® est la marque d'ITW Reagents pour tous les produits liés à la fixation des échantillons histologiques. Cela comprend le formaldéhyde pour les fixations de biopsies régulières, le formaldéhyde rose pour la fixation de minuscules biopsies et les décalcifiants pour la fixation des os.Que puis-je faire avec Histofix®-Safe?
Histofix®-Safe Est utilisé pour fixer des échantillons histologiques et pathologiques dans un dispositif sans contact avec le formol pour le traitement et la préparation de biopsies en vue d'une analyse microscopique.Qu'est-ce que Histofix®-Safe?
Histofix®-Safe est un récipient fermé utilisé en pathologie et en histologie qui permet de fixer des échantillons biologiques ou des biopsies de manière super-sécurisée, en évitant autant que possible le contact avec le formaldéhyde cancérigène.Quel liquide est utilisé dans Histofix®-Safe?
Histofix®-Safe contient du formol dilué à 4%, tamponné et stabilisé avec du méthanol, prêt à fixer des échantillons biologiques ou des biopsies pour l'analyse microscopique.De quoi est composé Histofix®-Safe?
Le dispositif Histofix®-Safe est composé de plastiques 100% recyclables tels que le polypropylène, ce qui permet une élimination des échantillons respectueuse de l'environnement et un plastique récupérable. Comment fonctionne le bouchon Histofix®-Safe ?Le bouchon Histofix®-Safe est bidirectionnel, ce qui permet au formol de s'écouler d'un récipient à l'autre tant qu'une pression est exercée sur l'un des récipients. Pour ce faire, il suffit d'appuyer sur le récipient supérieur jusqu'à ce que tout le liquide s'écoule dans le récipient inférieur à travers la valve bidirectionnelle. L'échantillon sera immergé dans le formaldéhyde, ce qui déclenchera le processus de fixation. Si aucune pression n'est exercée, le formol ne s'écoule pas d'un récipient à l'autre.
Histofix®-Safe est-il breveté ?
Oui, le dispositif Histofix Safe est breveté depuis janvier 2021 (numéro de brevet WO2021/016060A9).
Où puis-je acheter Histofix®-Safe?
Histofix®-Safe peut être acheté par l'intermédiaire de notre réseau de distributeurs dans le monde entier.
Quel est l'avantage du dispositif Histofix®-Safe?
Le principal avantage du dispositif Histofix®-Safe est que les échantillons biologiques ou les biopsies peuvent être fixés et transportés sans risque d'inhalation ou de contact avec les vapeurs de formol. Le dispositif Histofix®-Safe est également facile à stocker et à transporter, fabriqué en plastique recyclable, facile à utiliser, intuitif.
Quels échantillons puis-je utiliser pour Histofix®-Safe?
Tout type d'échantillon biologique ou de biopsie dont le volume est approprié peut être utilisé. L'échantillon ne doit pas être trop grand car il doit tenir à l'intérieur et il doit y avoir suffisamment de formol pour une fixation appropriée. En outre, l'échantillon ou la biopsie ne doit pas être trop petit pour ne pas fuir à travers la grille.
Quel volume dois-je choisir ?
Le dispositif Histofix®-Safe est disponible en trois conditionnements : 20 ml, 30 ml et 40 ml. La capacité à choisir dépend du volume de l'échantillon biologique. Le volume de fixateur doit être proportionnel au volume de l'échantillon. Pour les petites biopsies, un volume de liquide égal ou supérieur à 10 fois le volume du tissu peut généralement être utilisé.
Qu'entend-on par temps de fixation ?
Le temps de fixation approprié dépend également du volume de tissu et du type d'échantillon. En général, il peut être compris entre 6 heures pour les biopsies à l'aiguille ou endoscopiques et 24 heures pour les échantillons chirurgicaux.
L'Histofix®-Safe porte-t-il la marque CE IVD?
Oui, le dispositif Histofix®-Safe porte la marque CE IVD conformément au nouveau règlement (UE) 2017/746 sur les produits de diagnostic in vitro (IVDR) qui remplace l'ancienne directive 98/79/CE.
Literature
[1] SEAP-IAP, DOCUMENTO DE RECOMENDACIONES DE LA SOCIEDAD ESPAÑOLA DE ANATOMÍA PATOLÓGICA-IAP REFERENTE A LAS MEDIDAS DE SEGURIDAD ACONSEJADAS EN EL MANEJO DEL FORMALDEHÍD0 Y ALO USO DE FIJADORES ALTERNATIVOS, Ángel Concha López, Ramiro Álvarez Alegret, Fina Autonell Reixach, Rocío Cabrera Pérez, Miguel Ángel Carrasco García, Ignacio Claros González, Sagrario García Sánchez , Javier Gómez Román, Teresa Hermida Romero, Teresa Hernández Iglesias, Antonio Martínez Lorente, Antonio Martínez Pozo, Beatriz Torio Sánchez, Enrique de Álava Casado.[2] Documentation sur les brevets : WO2021/016060A9 28 janvier 2021, EP3766579 - Conteneur pour échantillons biologiques, EP 3 766 579 A1 DEMANDE DE BREVET EUROPÉEN, WO2021016060 - Conteneur pour échantillons biologiques.








