Presentaciones (1)
| código | presentación | precio por unidad | precio de caja por unidad | |
|---|---|---|---|---|
| Código y embalaje | Precio por unidad | |||

|
código
147145.3514
|
presentación
5 L
|
precio por unidad
individual
167,80€
|
precio de caja por unidad
142,63€x 4 unidades
|
Datos técnicos
- Descripción Física:
- Líquido
- Código de Producto:
- 147145
- Nombre de Producto:
- Hidrógeno Peróxido 35 % puro
- Descripción corta:
- Estabilización: estabilizado
- Especificaciones:
- Riqueza (titr.): mín. 35 %
Residuo fijo: máx. 0,05 %
Sust. React. ácido: máx. 0,025 %
- Pictogramas de peligrosidad
-
- UN:
- 2014
- Clase/GE:
- 5.1(8)/II
- ADR:
- 5.1(8)/II
- IMDG:
- 5.1(8)/II
- IATA:
- 5.1(8)/II
- WGK:
- 1
- Almacenaje:
- Temperatura ambiente
- Palabra de Peligro:
- Peligro
- Símbolos GHS:
- GHS05
GHS07
- Frases H:
- H302
H315
H318
H335
- Frases P:
- P261
P305+P351+P338
P310
P321
P330
P362+P364
P405
P501
- EINECS:
- 231-765-0
- NC:
- 28470000
- Índice No.:
- 008-003-00-9
Documentos
Consulta
Comments
El peróxido de hidrógeno (H2O2) es un compuesto líquido de hidrógeno y oxígeno de color azul pálido, incoloro en forma diluida y muy estable. Es ligeramente más viscoso que el agua, un ácido débil y un oxidante muy fuerte hacia la mayoría de las sustancias, reaccionando como tal violentamente con sustancias como el cobre, el latón, el yoduro de potasio y actuando así como un fuerte agente blanqueador y desinfectante. En una forma altamente concentrada, puede utilizarse como combustible único y como componente de cohetes.Historia
El peróxido de hidrógeno fue producido por primera vez en 1818 por Louis Jacques Thénard haciendo reaccionar peróxido de bario con ácido nítrico. El proceso se mejoró primero con ácido clorhídrico y después con ácido sulfúrico. Este último es especialmente adecuado porque el subproducto sulfato de bario precipita en el proceso. El proceso de Thénard se utilizó desde finales del siglo XIX hasta mediados del siglo XX.
Durante mucho tiempo se creyó que el peróxido de hidrógeno puro era inestable, ya que fracasaron los intentos de separarlo del agua producida durante la fabricación. Esto se debía a que los restos sólidos y los iones de metales pesados provocaban una degradación catalítica o incluso una explosión. El peróxido de hidrógeno absolutamente puro fue obtenido por primera vez mediante destilación al vacío en 1894 por Richard Wolffenstein.
Extracción y producción
En el pasado, el peróxido de hidrógeno se producía principalmente por electrólisis del ácido sulfúrico. En el proceso se forma ácido peroxodisulfúrico, que se hidroliza de nuevo para formar ácido sulfúrico y peróxido de hidrógeno.
2 S O 4 2 - ⟶ S 2 O 8 2 - + 2 e -
S 2 O 8 2 - + 2 H 2 O ⟶ H 2 O 2 + 2 H S O 4 -
Hoy en día, el peróxido de hidrógeno se produce técnicamente mediante el proceso de la antraquinona. Para ello, la antrahidroquinona se hace reaccionar con oxígeno atmosférico a presión para formar peróxido de hidrógeno y antraquinona. La antraquinona puede reducirse de nuevo con hidrógeno a antrahidroquinona en el siguiente paso.
La ecuación bruta es:
H 2 + O 2 ⟶ H 2 O 2
A escala de laboratorio, el peróxido de hidrógeno también se produce cuando los peróxidos se tratan con ácidos. Un reactivo históricamente importante es el peróxido de bario, que reacciona en una solución de ácido sulfúrico para formar peróxido de hidrógeno y sulfato de bario.
B a O 2 + 2 H 3 O + + S O 4 2 - ⟶ H 2 O 2 + B a S O 4 + 2 H 2 O
Las entalpías molares estándar de formación son:
ΔfH0 gas: -136,11 kJ/mol
ΔfH0 líquido: -188 kJ/mol
ΔfH0 sol: -200 kJ/mol
Propiedades
Propiedades físicas
El compuesto es miscible con agua en cualquier proporción. Aunque los puntos de fusión de los componentes puros son relativamente similares, en las mezclas se observan puntos de fusión significativamente más bajos. Se encuentra un dihidrato definido (H2O2-2H2O) que funde a -52,1 °C. Este forma dos eutécticos con los componentes puros a un contenido de peróxido de hidrógeno de 452 g/kg a -52,4 °C y de 612 g/kg a -56,5 °C. El peróxido de hidrógeno y el agua no forman una mezcla azeotrópica en ebullición.
Diagrama de fase sólido-líquido binario
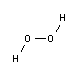
La molécula de H2O2 forma un ángulo con respecto a los dos planos O-O-H (ángulo dieder = 90,2±0,6°). La longitud del enlace O-O es de 145,3±0,7 pm, la del enlace O-H de 99,8±0,5 pm y el ángulo del enlace O-O-H de 102,7±0,3°. En la fase líquida, se forman enlaces de hidrógeno como en el agua. La estructura angular y la estructura modificada de los enlaces de hidrógeno dan lugar a una densidad considerablemente mayor y a una viscosidad ligeramente superior en comparación con el agua.
El peróxido de hidrógeno es un ácido muy débil. En el agua se establece el siguiente equilibrio
H 2 O 2 + H 2 O ⇌ H 3 O + + H O 2 -
La constante ácida es KS = 1,6-10-12 o pKS = 11,8.
Propiedades químicas
El peróxido de hidrógeno tiende a descomponerse en agua y oxígeno. Especialmente en soluciones muy concentradas y en contacto con superficies metálicas o en presencia de sales y óxidos metálicos, puede producirse una descomposición espontánea. La reacción de descomposición es fuertemente exotérmica con un calor de reacción de -98,20 kJ-mol-1 o -2887 kJ-kg-1. Además, se libera una cantidad considerable de gas con 329 l-kg-1 de peróxido de hidrógeno:
2 H 2 O 2 ⟶ 2 H 2 O + O 2
Desproporción de dos moléculas de peróxido de hidrógeno a agua y oxígeno.
Los calores específicos de descomposición se relativizan al aumentar la dilución, con una relación prácticamente lineal con la concentración de peróxido de hidrógeno.
Esta reacción de descomposición es catalizada por iones de metales pesados, iones I-- y OH--, entre otros. Por esta razón, en el comercio se añaden estabilizadores (incluido el ácido fosfórico) a las soluciones de H2O2. Es un fuerte agente oxidante. Al reducir el estado de oxidación de -I a -II, sólo se forman agua y oxígeno como productos de reacción. No hay subproductos difíciles de separar o perturbar, lo que simplifica su uso en el laboratorio.
Dependiendo de la posición de ambos potenciales redox, el H2O2 también puede actuar como agente reductor, así el MnVII (en permanganato potásico) se reduce en condiciones ácidas.
El peróxido de hidrógeno es un ácido muy débil; sus sales inorgánicas y ésteres orgánicos son los hidroperóxidos y peróxidos.
Propiedades biológicas (fisiología)
El peróxido de hidrógeno provoca heridas características de aparición retardada y dolor punzante gradual.
El peróxido de hidrógeno es muy corrosivo, especialmente en forma de vapor. Si le entra agua oxigenada en la piel, debe aclarar bien la zona con agua (dilución) o, al menos, retirar inmediatamente el agua oxigenada de la piel. Si penetra en la piel, se descompone rápidamente y las burbujas de oxígeno resultantes hacen que la piel aparezca blanca.
En general, el peróxido de hidrógeno tiene un efecto citotóxico y, debido a su fuerte toxicidad frente a muchos microorganismos procariotas, un efecto desinfectante.
El peróxido de hidrógeno se forma durante numerosos procesos bioquímicos. En el ciclo biológico, se produce por la metabolización oxidativa de los azúcares. El organismo se protege contra su efecto tóxico mediante enzimas -catalasas, peroxidasas- que lo descomponen de nuevo en O2 y H2O no tóxicos.
Además, el peróxido de hidrógeno es una molécula de señalización para la inducción de las defensas de la planta contra los agentes patógenos (aspecto de la citotoxicidad).
Coloración gris del cabello en la vejez
Investigadores alemanes y británicos anunciaron en un estudio en marzo de 2009 que la "coloración gris" (en realidad, coloración blanca) del cabello en la vejez es el resultado de una menor degradación del peróxido de hidrógeno en el cabello. Se pudo demostrar en experimentos de laboratorio que el peróxido de hidrógeno impide la función de la enzima tirosinasa, necesaria para la producción de melanina. Esto ocurre mediante la oxidación del aminoácido metionina contenido en la tirosinasa.
Utilización
El peróxido de hidrógeno, como oxidante fuerte, es adecuado para servir de portador de oxígeno en explosivos de combustión. Por ello, en concentraciones superiores a 120 g/kg, el suministro a personas que no actúen con fines laborales o profesionales y su posesión, uso y transferencia están prohibidos en la UE y sólo se permiten hasta 349 g/kg. Existen soluciones acuosas con concentraciones de hasta el 70% de H2O2 para uso industrial. Las soluciones muy concentradas de peróxido de hidrógeno pueden descomponerse espontáneamente en caso de explosión.
Blanqueo
El peróxido de hidrógeno es un agente blanqueador. La aplicación más común en todo el mundo es el blanqueo de la pasta de papel. La pasta se obtiene de la madera, y la lignina que contiene le da un tono amarillento que se considera objetable en el uso principal de la pasta para papel y productos de papel.
En artesanía, las maderas se blanquean con peróxido de hidrógeno durante su restauración o renovación y, de este modo, se aclaran.
Se utiliza tanto en el blanqueo como en la coloración, el tinte y el tinte intensivo y para fijar la remodelación permanente (permanente y ondulación con volumen), así como para fijar el alisado permanente del cabello. Por ello, un tono de rubio muy claro y artificial se denomina "rubio hidrógeno". La relación se aclara aún más con el término inglés peroxide blonde.
En odontología, se utiliza en diversas concentraciones para blanquear los dientes.
A menudo se utiliza como peróxido unido a carbamida.
El peróxido de hidrógeno y los agentes blanqueadores que contienen peróxido de hidrógeno, como una mezcla de ácido peroxiacético y peróxido de hidrógeno, también se denominan en el lenguaje publicitario con la palabra artificial "oxígeno activo". Aparte del peróxido de hidrógeno, también pueden utilizarse otros peróxidos para blanquear, que se descomponen al entrar agua y liberan el oxígeno atómico activo.
También se utiliza en taxidermia para blanquear el hueso de los cráneos de animales. Las concentraciones requeridas para ello exigen un oficio (cazador profesional) o un permiso de acuerdo con el apartado 3 del artículo 5 del Reglamento de la UE.
Tratamiento del agua
Agua potable
Cuando el peróxido de hidrógeno se expone a los rayos UV, se forma el radical hidroxilo, un oxidante mucho más potente que el propio peróxido. La siguiente es la ecuación para su formación:
H O O H → U V - L i c h t 2 ⋅ O H
Este fuerte efecto oxidante se utiliza en el tratamiento del agua para descomponer las impurezas orgánicas. Como ejemplo, el llamado proceso UVOX (luz UV y OXidación), con el que se puede eliminar de forma segura del agua potable el herbicida atrazina y su producto de degradación desetilatrazina o también otros ingredientes tóxicos. Mediante esta "combustión húmeda" de la atrazina, sólo se forman productos de degradación como agua, oxígeno, dióxido de carbono y nitrógeno, y no se produce una salinización adicional del agua. Además, este método sustituye al uso de carbón activado, que es significativamente más costoso.
Agua de refrigeración
El peróxido de hidrógeno también se añade a los circuitos de refrigeración para evitar la germinación, por ejemplo, de la legionela. Para ello, se añade automáticamente al agua de refrigeración peróxido de hidrógeno de mayor porcentaje (máximo 349 g/kg) a intervalos periódicos.
Desinfección y esterilización
Una solución al 3% de peróxido de hidrógeno se utiliza para la desinfección, también en el sector doméstico. Algunos ejemplos de uso son en la boca y la garganta (se diluye al 0,3% para enjuagues bucales), odontología, desinfección de lentes de contacto en limpiadores, esterilización de materiales de envasado o desinfección de manos en casos de enfermedad. Asimismo, se utiliza en cremas faciales: para limpiar los poros y combatir los granos y las impurezas de la piel. También se utiliza para desinfectar el agua en la depuración de aguas residuales industriales y en piscinas.
La solución al 35% de peróxido de hidrógeno se utiliza en la industria alimentaria en líneas de llenado aséptico para esterilizar botellas de PET, envases de plástico y los típicos envases de cartón multicapa. Numerosos productos alimentarios (bebidas, leche, productos lácteos, salsas, sopas) se envasan hoy en día asépticamente en cartones, vasos, botellas y películas para mejorar la vida útil y la calidad del producto. En este proceso, el material de envasado se desinfecta con peróxido de hidrógeno al 35% antes de introducir el alimento correspondiente.
Otro campo de aplicación es el uso de H2O2 gaseoso para la descontaminación de salas blancas. Para ello, se vaporiza en un aparato especial una solución normalmente al 35 por ciento y se insufla en la zona a descontaminar (sala, cámara, etc.).
El alto efecto bactericida del H2O2, la compatibilidad medioambiental y la buena viabilidad técnica son las razones del uso generalizado de este método.
Otro método para la desinfección de habitaciones con peróxido de hidrógeno es la nebulización en frío. En este proceso, el peróxido de hidrógeno se convierte en un aerosol y, dependiendo de la concentración (a partir del 3 %), se distribuye en la habitación mediante un generador de aerosoles según un ciclo de proceso definido. Los aerosoles tienen un tamaño de gota de 0,5-40 µm. El tamaño de las gotas depende de la tecnología utilizada para generar los aerosoles. Los aerosoles se distribuyen uniformemente en la habitación al cabo de poco tiempo. Un tamaño de gota pequeño tiene un efecto positivo en la distribución y la capacidad de flotación de las gotas. Dependiendo de las condiciones climáticas iniciales de la sala, algunas de las gotas presentes en la fase líquida se convierten en fase gaseosa. La energía necesaria para ello se toma de la temperatura ambiente. El proceso es idéntico al de la humidificación adiabática. El medio se mezcla con el aire ambiente y, cuando se utiliza correctamente, provoca una desinfección holótica. El aparato (generador) para la nebulización, así como el proceso especial, deben validarse previamente para comprobar su eficacia. Además, su eficacia debe probarse sobre la base de las normas existentes. El sistema compuesto por el producto de desinfección y el generador de aerosol se somete a pruebas de eficacia en un laboratorio.
Para el caso especial del SARS-CoV-2/COVID-19, una revisión sistemática realizada en 2020 sobre los enjuagues bucales a base de peróxido de hidrógeno (H2O2) concluye que no tienen ningún efecto sobre la actividad virucida y recomienda que "se revisen los protocolos de higiene dental durante la pandemia de COVID-19".
Oxigenación
El peróxido de hidrógeno puede utilizarse en acuarios para suministrar oxígeno. La generación de oxígeno se realiza en un oxidante. Para ello, el peróxido de hidrógeno se divide en agua y radicales de oxígeno con ayuda de un catalizador en un recipiente del acuario.
Contra la infestación de moho
Al renovar interiores, la infestación de moho puede combatirse con peróxido de hidrógeno. Tiene un efecto desinfectante tanto contra las células fúngicas biológicamente activas -como fungicida- como contra las esporas de moho llamadas "conidios".
Gracias a su efecto blanqueador, también elimina "ópticamente" los restos de moho de las superficies porosas. El peróxido de hidrógeno tiene algunas ventajas sobre el alcohol o la lejía de cloro porque, a diferencia del alcohol, no es inflamable, tiene un efecto blanqueador y, a diferencia de la lejía de cloro, no deja subproductos clorados.
Medicina
En odontología, el H2O2 se utiliza como solución acuosa al tres por ciento para la desinfección local del tejido dental y para la hemostasia durante procedimientos menores. En medicina y urgencias, la sustancia puede utilizarse para desinfectar superficies, instrumental, piel y mucosas. Hoy en día, el peróxido de hidrógeno se sigue utilizando esporádicamente en la limpieza de heridas, pero entretanto ha perdido su importancia tradicional, ya que se inactiva rápidamente dentro de la herida al entrar en contacto con los glóbulos rojos y forma espuma, por lo que sólo despliega su efecto durante un breve espacio de tiempo.
Desde hace algún tiempo se utiliza un proceso para esterilizar determinados dispositivos médicos e instrumentos quirúrgicos en el que se emplea H2O2 como producto químico de proceso (proceso de plasma de H2O2). Tiene ventajas sobre la esterilización por vapor, especialmente para los productos termolábiles. Por ejemplo, puede evaporarse al vacío a temperatura ambiente y, además, ionizarse.
El H2O2 también se utiliza para desinfectar piercings. Se supone que desinfecta la zona afectada y coagula posibles hemorragias, lo que acelera el proceso de cicatrización.
Agricultura
En agricultura, el peróxido de hidrógeno se utiliza para la desinfección en invernaderos y para la oxigenación en soluciones nutritivas de cultivos hidropónicos. El peróxido de hidrógeno también se utiliza para desinfectar sistemas de tuberías de agua potable o equipos de establos, por ejemplo en la cría de cerdos.
Biología
Para la determinación de cultivos bacterianos, se realiza la prueba de la catalasa con una solución de peróxido de hidrógeno al tres por ciento. La mayoría de las bacterias aerobias y anaerobias facultativas, así como los hongos, tienen la enzima catalasa, que es capaz de dividir el H2O2, que es tóxico para las células.
Experimentalmente, el peróxido de hidrógeno se utiliza en biología para inducir la muerte celular programada de células eucariotas aisladas.
Medicina forense
El peróxido de hidrógeno se ha utilizado en medicina forense para detectar sangre. Louis Jacques Thénard descubrió en 1818 que la hemoglobina descompone el peróxido de hidrógeno. En 1863, Christian Friedrich Schönbein desarrolló un análisis de sangre a partir de este peróxido. Hoy en día, sin embargo, se utiliza la prueba de Kastle-Meyer, más sensible, para detectar la sangre.
En las autopsias de cadáveres muy descompuestos, la solución de peróxido de hidrógeno puede utilizarse para hacer visibles de nuevo los tatuajes que se han vuelto irreconocibles debido a cambios en la piel. Esto puede ser importante para la identificación.
Agente grabador
En microelectrónica, la mezcla de ácido sulfúrico y peróxido de hidrógeno -llamada "piraña"- se utiliza para limpiar la superficie de las obleas y producir una fina capa de óxido hidrófilo en ellas, de unos tres o cuatro nanómetros de espesor. Hoy en día, el nombre "SPM" (mezcla de peróxido sulfúrico) es más común. Su principal aplicación es la eliminación de fotorresistencias de las obleas.
Los baños de grabado con cloruro de cobre que contienen peróxido de hidrógeno concentrado se utilizan para eliminar el cobre en la producción de placas de circuitos impresos (PCB):
C u + C u C l 2 ⟶ 2 C u C l
El cobre elemental reacciona con el cloruro de cobre (II) para formar cloruro de cobre (I). Se trata de una comproporación.
El peróxido de hidrógeno se utiliza junto con el ácido clorhídrico para regenerar los baños de grabado de cloruro de cobre:
2 CuCl + 2 Cl ( aq ) - + 2 H 3 O ( aq ) + + H 2 O 2 ⟶ 2 CuCl 2 + 4 H 2 O
Al reaccionar el cloruro de cobre(I) con peróxido de hidrógeno y ácido clorhídrico, se regenera el cloruro de cobre(II). El átomo de cobre se oxida en el proceso.
La adición de peróxido de hidrógeno y ácido clorhídrico se controla mediante el potencial redox; las fotoresinas utilizadas aquí son estables frente al peróxido de hidrógeno.
Motores para cohetes/torpedos
Como suministrador de oxígeno, el H2O2 se utiliza en submarinos por descomposición (preferentemente mediante dióxido de manganeso). En forma concentrada, se utilizaba en los motores de cohetes del Max Valier y del Messerschmitt Me 163, y también en los motores de submarinos (submarino Walter). El peróxido de hidrógeno descompuesto con la ayuda de permanganato potásico se utilizó como gas propulsor para las bombas de combustible (370 kW de potencia) del cohete A4 (también conocido como el "arma milagrosa V2").
En los cohetes británicos (por ejemplo, el Black Arrow) se utilizaba peróxido de hidrógeno sin descomponer al 85% como líquido portador de oxígeno a temperatura normal y se quemaba con parafina.
Una de las tesis sobre el hundimiento del submarino nuclear ruso K-141 Kursk en 2000 afirmaba que el peróxido de hidrógeno se filtró de un tanque de un torpedo, reaccionó con óxido de hierro en el tubo de lanzamiento y se incendió. El torpedo explotó y provocó un incendio devastador.
Este tipo de mezcla de combustible (85-98% de peróxido de hidrógeno) para cohetes y torpedos también se denomina HTP (High Test Peroxide).
El peróxido de hidrógeno tiende a descomponerse de forma incontrolada. Así, el 16 de julio de 1934, Kurt Wahmke y dos técnicos murieron en Kummersdorf en la explosión de un motor que funcionaba con peróxido de hidrógeno. Debido al peligro en su uso y manipulación (efecto corrosivo, descomposición incontrolada, explosión en caso de contaminación en el depósito y el sistema de tuberías), su uso se limita hoy en día a pequeños motores de cohetes (intentos de récord, motores de control).
El cohete sonda polaco ILR-33 Burstyn utiliza como propulsante un 98% de peróxido de hidrógeno, que se descompone catalíticamente.
Los riesgos de incendio pueden surgir en combinación adecuada con limaduras de hierro y trapos de limpieza; por ello, las normas de prevención de accidentes prescriben medidas de precaución para el tratamiento del agua de proceso en las plantas metalúrgicas.
Producción de explosivos
Debido al grupo peróxido, el compuesto es rico en energía y se descompone con la liberación de oxígeno. El peróxido de hidrógeno reacciona con la acetona en presencia de un catalizador adecuado para formar peróxido de acetona, que es un triperóxido de triacetona y se conoce como explosivo TATP. El explosivo hexametileno triperóxido diamina (HMTD) también se produce utilizando peróxido de hidrógeno.
Analítica
Analítica cualitativa y cuantitativa clásica
Estos métodos clásicos están perdiendo importancia en la práctica de laboratorio debido a sus bajos límites de detección y a lo engorrosos que resultan.
Detección como peróxido de cromo azul (CrO(O2)2)
El trióxido de cromo CrO3 se transforma en el rango fuertemente ácido (pH<0) mediante peróxido de hidrógeno en peróxido de cromo(VI) de color azul intenso y soluble en éter. Para ello, el dicromato potásico se acidifica en el tubo de ensayo con ácido sulfúrico diluido y se cubre con un poco de éter. En presencia de H2O2, la fase de éter se vuelve azulada. Debido al uso de compuestos de cromo (VI) tóxicos y cancerígenos, esta prueba ya sólo tiene interés académico.
Detección como ion amarillo de peroxotitanilo(IV)
La detección como amarillo de titanio (no confundir con el reactivo orgánico del mismo nombre) es muy sensible. Los iones de titanio (IV) reaccionan con trazas de peróxido de hidrógeno para formar iones complejos de peroxotitanilo de color amarillo anaranjado intenso.
Valoración redox con permanganato potásico
La concentración de peróxido de hidrógeno en una solución acuosa de ácido sulfúrico puede determinarse por titulación con permanganato potásico. Si en su lugar hay ácido clorhídrico, se añade solución de Reinhardt-Zimmermann. La valoración se basa en la reacción siguiente
2 MnO 4 - + 5 H 2 O 2 + 6 H 3 O + ⟶ 2 Mn 2 + + 5 O 2 + 14 H 2 O
El cambio de color es de incoloro a un tenue color rosado, que debe persistir durante un minuto. El consumo de 1 ml de solución de KMnO4 (0,02 mol/l = 0,1N) corresponde a 1,701 mg de H2O2. Este método también puede utilizarse para valorar compuestos que desprenden H2O2 en solución de ácido sulfúrico, como peróxidos, perboratos o percarbonatos.
Detección con papel de almidón yodado
El papel de filtro impregnado de yoduro que contiene almidón indica incluso pequeñas cantidades de peróxido por coloración azul. En este caso, el peróxido oxida el yoduro a yodo, que a su vez forma un complejo azul característico junto con el almidón.
Análisis cuantitativo instrumental
Métodos ópticos
Fotometría
La capacidad oxidante del H2O2 permite una multitud de reacciones cromogénicas (en parte catalizadas enzimáticamente). Así, son posibles determinaciones fotométricas o reflectométricas del H2O2. Una de las reacciones de oxidación más probadas es la "reacción de Trinder" del fenol con 4-aminoantipirina a un colorante violeta. La absorbancia es proporcional a la concentración del analito y puede medirse a 510 nanómetros. Las modificaciones químicas de los reactivos también permiten la medición a longitudes de onda de 550 y 750 nanómetros. Con este método puede alcanzarse un límite de detección de 1 µmol.
Fluorometría
Probablemente uno de los métodos de detección más importantes para el peróxido de hidrógeno es la oxidación catalizada por peroxidasa del rojo Amplex por H2O2 a resorufina. La resorufina muestra una clara fluorescencia a 590 nanómetros tras excitación a 535 nanómetros, mientras que el Rojo Amplex no presenta fluorescencia. De este modo puede determinarse la concentración de peróxido de hidrógeno con un límite de detección de 5 nmol/l.
Sensores amperométricos
Los sensores amperométricos para la detección de peróxido de hidrógeno se conocen desde hace mucho tiempo. El principio de medición se basa en el hecho de que el peróxido de hidrógeno se reduce catódicamente o se oxida anódicamente en un electrodo de trabajo a un potencial constante. La corriente resultante es proporcional a la concentración de H2O2. El potencial para la reducción catódica suele estar entre -100 y -200 mV y la ventana de potencial para la oxidación anódica oscila entre 600 y 800 mV con respecto a un electrodo de referencia Ag/AgCl.
Otro enfoque es la inmovilización de enzimas (como la peroxidasa de rábano picante) en una capa compuesta de nanotubos de carbono y quitosano. Con estos biosensores se alcanzó un límite de detección de 10,3 µmol/l. Los sensores biomiméticos no enzimáticos basados en nanopartículas magnéticas de óxido de hierro desempeñan un papel cada vez más importante. Éstas asumen la función catalítica de la peroxidasa y permiten un límite de detección de 3,6 µmol/l. Otras sondas utilizan los llamados nanocables Mn-NTA (complejo de nitrilotriacetato de manganeso), que controlan amperométricamente la oxidación electroquímica del peróxido de hidrógeno. Se ha descrito un límite de detección de 0,2 µmol/l.
