Presentaciones (4)
| código | presentación | precio por unidad | precio de caja por unidad | |
|---|---|---|---|---|
| Código y embalaje | Precio por unidad | |||

|
código
258462.0955
|
presentación
50x20 ml
|
precio por unidad
individual
153,80€
|
precio de caja por unidad
|

|
código
258462.0961
|
presentación
50x40 ml
|
precio por unidad
individual
164,00€
|
precio de caja por unidad
|

|
código
258462.0962
|
presentación
50x30 ml
|
precio por unidad
individual
158,90€
|
precio de caja por unidad
|

|
código
258462.1255
|
presentación
11x20 ml
|
precio por unidad
individual
33,85€
|
precio de caja por unidad
|
Datos técnicos
- Densidad:
- 1,019 kg/l
- Solubilidad:
- Miscible con agua
- Descripción Física:
- Líquido
- Código de Producto:
- 258462
- Nombre de Producto:
- Histofix®-Safe Conservante listo para su uso (CE-IVD) para diagnóstico clínico
- Nombre de Calidad:
- para diagnóstico clínico
- Comentario de Cabecera:
- Producto sanitario para diagnóstico in vitro de clase A conforme al Reglamento (UE) 2017/746
- Especificaciones:
- Riqueza (Yodom.): 3,7-4,0 %
pH: 6,8-7,2
Metanol (p/v): 1 - 1,5 %
- Pictogramas de peligrosidad
-
- Almacenaje:
- Temperatura ambiente.
- Palabra de Peligro:
- Peligro
- Símbolos GHS:
- GHS08
GHS07
- Frases H:
- H350
H317
H341
H302
- Frases P:
- P201
P202
P261
P272
P280
P281
P302+P352
P308+P313
P321
P333+P313
P363
P405
P501
- Nombre Maestro:
- Histofix®-Safe Conservante listo para su uso
- NC:
- 38229000
Documentos
Consulta
Comments
HistologíaLa histología es el área de la biología que estudia la composición, estructura y características de los tejidos orgánicos de los seres vivos. La histología está estrechamente relacionada con la anatomía microscópica, ya que su estudio no se detiene en los tejidos, sino que va más allá, observando también las células internamente y otros corpúsculos, y está relacionada con la bioquímica, la citología y la medicina.
La histología ha adquirido una gran importancia en la medicina y la biología, ya que es crucial para estas disciplinas porque se encuentra entre las intersecciones de la bioquímica, la biología molecular y la fisiología, por un lado, y los procesos patológicos y sus consecuencias, por otro.
Las técnicas histológicas clásicas se aplican en los laboratorios médicos para el diagnóstico de una gran variedad de enfermedades. Estas técnicas son adecuadas en la mayoría de los casos de diagnóstico. Sin embargo, cuando el diagnóstico con estas técnicas clásicas no puede considerarse fiable, deben utilizarse métodos adicionales. Estas técnicas incluyen la tinción histoquímica, los métodos inmunohistoquímicos, la hibridación del ADN, la hibridación fluorescente in situ (FISH), la PCR y la citometría de flujo, entre otros.
Los laboratorios médicos antes mencionados se centran esencialmente en la ciencia aplicada principalmente basada en la producción (número de pruebas diagnósticas), a diferencia de los laboratorios de investigación que se centran en la ciencia básica sobre una base académica.
Un laboratorio médico o laboratorio clínico es el lugar en el que se suelen realizar pruebas en muestras clínicas con el fin de obtener información sobre la salud de un paciente en lo que respecta al diagnóstico, el tratamiento y la prevención de enfermedades.
Los laboratorios de investigación utilizan técnicas convencionales para los procedimientos de Genómica, Proteómica y Cultivo Celular.
Productos PanReac AppliChem para los laboratorios de los hospitales:
Laboratorios médicos: Productos para Microscopía.
Laboratorios de investigación: Productos para Genómica, Proteómica y Cultivo Celular.
Laboratorios médicos
En muchos países hay principalmente dos tipos de laboratorios médicos según el tipo de investigación realizada.
Laboratorios de hospital: laboratorio adjunto a un hospital para realizar pruebas a los pacientes. Podemos encontrar 4 tipos diferentes:
Patología clínica: hematología, histopatología, citología, patología de rutina
Microbiología clínica: bacteriología, micobacteriología, virología, micología, parasitología, inmunología, serología.
Bioquímica clínica: análisis bioquímicos, ensayos hormonales, etc.
Laboratorio de diagnóstico molecular o citogenética y laboratorio de biología molecular.
Laboratorios clínicos externos: para pruebas extremadamente especializadas, la muestra puede ir a un laboratorio de investigación externo.
ITW Reagents ofrece una gama completa de productos para histología, hematología y microbiología bajo la marca PanReac AppliChem, que incluye los reactivos más utilizados en el proceso de preparación de muestras para su examen en el microscopio. Con esta gama se cubren todas las etapas de fijación, aclarado, inclusión de parafina, tinción y montaje. También disponemos de una amplia gama de productos para la investigación en diferentes campos de Life Sciences para ensayos que se desarrollarán en los laboratorios de los hospitales: genómica, proteómica y cultivos celulares.
Muchos de los productos de la marca PanReac AppliChem utilizados en microscopía llevan el marcado CE IVD en cumplimiento del nuevo Reglamento Europeo (UE) 2017/746 sobre productos de diagnóstico in vitro (IVDR).
Técnicas y etapas del procesamiento histológico
Aunque la mayoría de las etapas del procesamiento histológico son comunes, algunas de ellas son exclusivas de un solo tipo de procesamiento de muestras. Por ejemplo, la inclusión se hace solo en tejidos y la fijación por calor solo en muestras de sangre.
Las etapas más comunes y los productos utilizados en ellas son los siguientes:
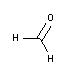
Fijación: La fijación interrumpe procesos de degradación que aparecen tras la muerte celular, tratando de conservar la arquitectura y composición tisular/celular lo más próxima posible a como se encontraba en el organismo vivo. El tipo más habitual es la fijación química con Formaldehído 3,7-4,0% p/v tamponado a pH=7 y estabilizado con metanol y, para una seguridad aumentada, el formol monodosis Histofix® Conservante listo para su uso.
Deshidratación y aclarado: La deshidratación es la eliminación completa del agua del espécimen o muestra de tejido para que se pueda incrustar adecuadamente en los medios de inclusión no hidrosolubles posteriores. Las piezas fijadas y lavadas se pasan por alcohol del 96% y luego por alcohol absoluto durante un tiempo variable, normalmente una hora y media en cada baño. El aclarado es la sustitución del agente deshidratante por una sustancia miscible con el medio de inclusión que vaya a utilizarse. Los productos más habituales en esta etapa son los alcoholes como el Etanol absoluto, Etanol 96%, Etanol 70% que pueden estar desnaturalizados o no además del Xileno.
Inclusión: La inclusión consiste en sustituir el agua del tejido por un medio líquido capaz de solidificarse en condiciones de temperatura adecuadas. Para ello se utiliza la Parafina P.F. 55-58°C plastificada + DMSO en lentejas o simplemente la Parafina P.F. 56-58°C en lentejas.
Corte: Los tejidos incluidos en la parafina se reducen a cortes lo suficientemente finos (4-6 micras) para permitir el paso de la luz para examinarla bajo un microscopio. Esto se hace con un microtomo: un instrumento mecánico que se utiliza para hacer secciones micrométricas de tejido. Recomendamos nuestro limpiador de parafina para mantener el micrótomo limpio.
Desparafinación-Hidratación: La desparafinación-hidratación es el proceso de eliminar el medio de inclusión de las secciones de tejido embebidas en parafina y rehidratarlas para una penetración adecuada de los colorantes. Los reactivos más habituales en esta etapa son los alcoholes como el Etanol absoluto, Etanol 96%, Etanol 70% que pueden estar desnaturalizados o no además del Xileno.
Tinción: La mayoría de los tejidos, sobre todo los de origen animal, son incoloros a menos que contengan algún tipo de pigmento. Por lo tanto, es necesario teñirlos para su observación con el microscopio. Esto se consigue con el uso de los colorantes, sustancias que, en contacto con un soporte adecuado, se unen a él de forma duradera transmitiéndole su color. Los colorantes más comúnmente utilizados son las Hematoxilina y la eosina, pero existe una gran variedad de tinciones dependiendo del tejido que se ha de colorear.
Montaje e inmersión: Una vez que las preparaciones hayan sido aclaradas, deben ser montadas definitivamente. Los agentes de montaje pueden ser acuosos y no acuosos; el tipo utilizado depende del protocolo correspondiente. Ejemplos de medios de montaje son el DPX, Bálsamo de Canadá y Eukitt®. Los medios de inmersión son líquidos, frecuentemente aceites naturales, que tienen un índice de refracción definido. Es importante que el índice de refracción sea de aproximadamente 1,5 (mismo índice que el vidrio). Esto permite una inmersión en aceite homogénea. Para ello se utiliza el Aceite de Inmersión o el Aceite de Cedro.
Análisis microscópico: Es la fase de observación al microscopio. No se necesitan reactivos adicionales.
FAQs
¿Qué es la Histología?
La Histología es una asignatura de Biología/Medicina que estudia la composición, estructura y características de los tejidos orgánicos de los seres vivos. La Histología está estrechamente relacionada con la anatomía microscópica, ya que su estudio no se detiene en los tejidos, sino que va más allá, observando también las células internamente y otros corpúsculos, relacionándose con la bioquímica y la citología.¿Qué se entiende por fijación en histología?
En el ámbito de la histología, patología y biología celular, la fijación consiste en preservar los tejidos biológicos del deterioro por autolisis o putrefacción. Detiene cualquier reacción bioquímica en curso y también puede aumentar la resistencia mecánica o la estabilidad del tejido tratado. La fijación de tejidos es un paso fundamental en la preparación de secciones histológicas. El objetivo general de la fijación es preservar las células y los componentes tisulares de forma que se puedan producir secciones finas y teñidas. Esto permite estudiar la estructura de los tejidos, que viene determinada por la forma y el tamaño de las macromoléculas (dentro y alrededor de las células), como las proteínas y los ácidos nucleicos.¿Qué se entiende por autolisis?
Se denomina autolisis a la destrucción de células o tejidos por sus propias enzimas, especialmente las liberadas por los lisosomas.¿Qué se entiende por putrefacción?
La putrefacción es la descomposición de la materia orgánica, especialmente el desdoblamiento típicamente anaeróbico de las proteínas por bacterias y hongos, con la formación de productos malolientes incompletamente oxidados. El proceso de putrefacción lo inician las bacterias presentes en el medio ambiente. Estas bacterias descompondrán la materia orgánica y producirán productos de desecho, como metano y amoníaco. Estos gases harán que el objeto se hinche y desprenda un olor desagradable.¿Qué es un medio de infiltración de tejidos?
Un medio de infiltración de tejidos es una formulación especial de parafina purificada y polímeros plásticos para infiltrar o incrustar la muestra biológica.¿Cómo puedo eliminar el agua de una muestra de tejido/biopsia?
Este proceso ¿qué proceso? se realiza comúnmente sumergiendo los especímenes en una serie de soluciones de etanol (alcohol) de concentración creciente hasta que se alcanza el alcohol puro, libre de agua. El etanol es miscible con el agua en todas las proporciones, de modo que el agua de la muestra es sustituida progresivamente por el alcohol.¿Qué disolventes puedo utilizar para la eliminación de agua en muestras de tejido/biopsias en histología/patología?
Etanol absoluto, etanol 96%, etanol 70 % son los disolventes más utilizados. Debido a que la parafina fundida es hidrofóbica (inmiscible con el agua), la mayor parte del agua de una muestra debe ser eliminada antes de que pueda ser infiltrada con parafina. Este proceso suele llevarse a cabo sumergiendo las muestras en una serie de soluciones de etanol (alcohol) de concentración creciente hasta conseguir alcohol puro sin agua. El etanol es miscible con el agua en todas las proporciones, de modo que el agua de la muestra es sustituida progresivamente por el alcohol. Se utiliza una serie de concentraciones crecientes de alcohol para evitar un deterioro excesivo del tejido.¿Qué se entiende por serie de deshidratación graduada en la preparación de biopsias histológicas?
La deshidratación es el proceso de eliminación completa del agua del tejido fijado. Para la deshidratación se utilizan concentraciones graduadas de etanol; el tejido se sumerge en etanol al 70% en agua, seguido de soluciones al 96% y al 100%. El etanol garantiza una deshidratación total, por lo que es el reactivo de elección para el procesamiento de muestras de microscopía electrónica. Para tejidos delicados se recomienda iniciar el procesado en etanol al 30%. Los desecantes deben ser solubles en agua, y el etanol es el agente deshidratante más utilizado. El etanol tiene varias propiedades especiales para la deshidratación: miscibilidad completa con el agua, efecto endurecedor, alto poder de deshidratación y permeabilidad del tejido. Para evitar una rigidez excesiva del tejido, suele ser necesario utilizar etanol graduado (normalmente en concentraciones sucesivas del 70%, 80%, 95% y etanol absoluto) para sustituir gradualmente el agua del tejido. También puede utilizarse isopropanol para sustituir al EtOH, pero con cambios en el protocolo de deshidratación patrón. Dependiendo del tamaño o tipo de las muestras, se debe optimizar el tiempo en el Isopropanol graduado. Las muestras muy pequeñas pueden endurecerse en exceso, y los especímenes grasos o de mayor tamaño necesitarán más deshidratación. El isopropanol no se mezcla con la parafina, por lo que será necesario utilizar un agente aclarante como el xileno.¿Qué es la microscopía de campo claro?
La microscopía de campo claro (BF) es el más sencillo de los métodos de iluminación en microscopía óptica. La muestra se transilumina con luz blanca (es decir, se ilumina desde abajo y se observa desde arriba) y el contraste de la muestra se debe a la atenuación de la luz transmitida en las zonas densas de la muestra. La microscopía de campo claro es la más sencilla de las técnicas utilizadas para iluminar muestras en microscopios ópticos, y su simplicidad la convierte en una técnica muy popular. El aspecto típico de una imagen de microscopía de campo claro es el de una muestra oscura sobre un fondo brillante, de ahí su nombre.¿Qué se entiende por deshidratar en histología?
La deshidratación es el proceso de eliminación completa del agua del tejido fijado. Para la deshidratación se utilizan concentraciones graduadas de etanol; el tejido se sumerge en etanol al 70% en agua, seguido de soluciones al 96% y al 100%. La mayoría de los medios de infiltración (la matriz de soporte sólido para cortar las muestras de tejido) son hidrófobos, por lo que es necesario eliminar el agua de los tejidos antes de seguir procesándolos. Existen dos métodos generales para deshidratar los tejidos. El método más común es la sustitución gradual del agua por un disolvente orgánico transportando el tejido a través de soluciones de concentración creciente (etanol, acetona), lo que se denomina serie de deshidratación graduada. Un método menos habitual en microscopía de campo claro es la deshidratación rápida con un reactivo orgánico (acetato de 2-metoxi-etilo, dimetoxi propano, fosfato de trietilo). La deshidratación rápida sustituye rápidamente el agua del tejido sin dañar la tensión superficial, como puede ocurrir con los alcoholes o la acetona. El 2-metoxi acetato de etilo y el dimetoxi propano tienen regiones hidrofílicas e hidrofóbicas. Esto permite que el disolvente interactúe con los lípidos de las membranas biológicas sin destruirlos. La deshidratación resultante se produce a través de un mecanismo de flujo de masa en lugar de una reacción química. El beneficio relativo de cada método es subjetivo y depende de los tejidos implicados y de las preferencias personales. En el pasado, la deshidratación rápida se limitaba a los procedimientos de infiltración plástica, pero sin duda puede utilizarse con técnicas de parafina.¿Qué se entiende por tinción en histología?
Una tinción o colorante es una ayuda utilizada en microscopía para aumentar el contraste de la imagen vista al microscopio. Las tinciones son sustancias que se utilizan habitualmente en biología y medicina para resaltar las estructuras de los tejidos biológicos que se van a observar con distintos tipos de microscopios. Se pueden utilizar distintos colorantes para aumentar la nitidez y examinar grandes secciones de tejido (por ejemplo, para resaltar las fibras musculares o el tejido conjuntivo), para resaltar poblaciones celulares (por ejemplo, para clasificar distintas células sanguíneas) o incluso para resaltar orgánulos dentro de células individuales. En bioquímica, significa añadir un colorante específico (que se une selectivamente al ADN, proteínas, lípidos, carbohidratos, etc.) a un sustrato para calificar o cuantificar la presencia de un compuesto concreto. Tanto la tinción como el etiquetado fluorescente pueden servir para el mismo propósito. También se utilizan diferentes tipos de colorantes biológicos para etiquetar células en citometría de flujo y para etiquetar proteínas o ácidos nucleicos en electroforesis en gel.¿Cuáles son los tipos de tinción en histopatología?
Podemos encontrar diferentes tipos de tinciones según el tipo de diagnóstico como Hematoxilina y Eosina, Tinción de Gram, Tinción de Giemsa, Reacción Periódica Ácido de Schiff, Tricrómico de Masson, Rojo Congo, Azul de Prusia, Mucicarmina, Sudán Negro Oleo, Rojo O, Tinción de Plata, Tinción de Nissl, Tinción de Papanicolaou.¿Cuál es el método de tinción más común?
Tinción rutinaria de hematoxilina y eosina (H & E). Es la tinción histológica más común, utilizada para diferenciar diferentes estructuras tisulares. También juega un papel importante en el diagnóstico de diversas patologías.¿Qué se entiende por aclaramiento en histología?
La limpieza es un paso esencial en el procesamiento histopatológico para microscopía óptica. El objetivo de la limpieza es eliminar los agentes deshidratantes (etanol) de los tejidos y prepararlos para la impregnación con el agente de inclusión (parafina). El xileno es el agente de limpieza más utilizado en todo el mundo.¿Qué es una biopsia?
Una biopsia es una muestra de tejido extraída del cuerpo para su posterior examen. Un médico debe recomendar una biopsia cuando una prueba inicial indica que una zona de tejido del cuerpo no es normal. Los médicos denominan lesión, tumor o masa a una zona de tejido anormal. Se trata de términos generales para enfatizar la naturaleza desconocida del tejido. La zona sospechosa puede descubrirse durante una exploración física o internamente durante una prueba de imagen.¿Qué es una muestra biológica en histología?
En histología una muestra biológica es un material como orina, sangre, tejido, células, ADN, ARN o proteínas de humanos, animales o plantas. Las muestras biológicas se utilizan para pruebas de laboratorio o se almacenan en un depósito biológico para su uso en investigación.¿Cuál es el flujo de trabajo habitual en histología?
El flujo de trabajo común en el laboratorio de histología consiste en son los pasos principales por los que pasa una muestra biológica o biopsia desde la recogida de la muestra hasta su examen al microscopio. Este flujo de trabajo incluye los siguientes pasos: fijación, secado, limpieza, tinción, incrustación y montaje.¿Qué tinciones se utilizan en histología?
Las tinciones más utilizadas en histología son las siguientes: Tinciones de rutina: Hematoxilina y Eosina; Tinciones especiales: Van Gieson, Azul de Toluidina, Azul de Alcian, Giemsa, Reticulina, Nissl, Orceína, Sudán Negro B. Tricrómico de Masson, Tricrómico de Mallory, Tricrómico de Azan, Tricrómico de Cason, Ácido Periódico de Schiff, Resorcina de Weigert y Fucsina.¿Cómo puedo fijar una biopsia?
Una biopsia puede fijarse con formaldehído o formol. Este proceso se denomina fijación. El propósito del formaldehído o la formalina es fijar el tejido para detener los cambios autolíticos en las biopsias. Todas las muestras deben colocarse inmediatamente después de la escisión en formalina tamponada neutra al 10% para permitir que se "fijen". Lo ideal es que la cantidad de fijador sea al menos diez veces el volumen de la muestra.¿Cuál es la diferencia entre formaldehído y formol?
La diferencia, básicamente, el formaldehído es un gas incoloro, soluble en agua, inflamable a temperatura ambiente y con un olor penetrante e irritante. Sin embargo, la formalina es un líquido, que se prepara mezclando gas formaldehído y agua. Esta es la principal diferencia entre la formalina y el formaldehído. Por lo general, una solución saturada de formalina contiene aproximadamente un 40% (en volumen) o un 37% (en peso) de gas formaldehído y un estabilizador para evitar la polimerización del formaldehído.¿Es cancerígeno el formaldehído?
El formaldehído es una de las sustancias evaluadas más exhaustivamente. En 2014 el formaldehído fue reclasificado como carcinógeno de categoría 1B. La nueva clasificación entró en vigor en junio de 2014 al publicarse en el Diario Oficial de la Unión Europea (REGLAMENTO (UE) nº 605/2014 DE LA COMISIÓN de 5 de junio de 2014).¿Por qué se utiliza el etanol en histología?
En histología, el etanol se utiliza como agente deshidratante y rehidratante. La deshidratación sirve para preparar el espécimen que se va a incrustar en parafina y para eliminar la parafina con el uso de xileno como disolvente intermedio. El xileno no es miscible con el agua. El etanol 96% contiene algo de agua. Por lo tanto, se debe utilizar etanol absoluto como "puente" entre el xileno y el etanol 96%.¿Por qué se utiliza el xileno en histología?
En histología, el xileno se utiliza para procesar y teñir tejidos. Se prefiere el xileno para el procesamiento de tejidos porque hace que el tejido sea transparente para que la parafina pueda recubrir completamente el tejido. Cuando se preparan portaobjetos para microscopía, el xileno puede eliminar cualquier residuo de parafina de los portaobjetos.¿Qué es la técnica de la parafina?
En histología y patología, mediante la aplicación de la técnica de la parafina, las biopsias se fijan e incrustan en cera. Esto hace que el tejido se endurezca y sea mucho más fácil cortar secciones del mismo en el micrótomo. A continuación, las secciones se tiñen y se examinan con un microscopio óptico.¿Qué significa Histofix®?
Histofix® es la marca de ITW Reagents para todos los productos relacionados con la fijación de muestras histológicas. Esto incluye el formaldehído para fijaciones regulares de biopsias, el formaldehído rosa para la fijación de biopsias diminutas y los descalcificadores para la fijación de huesos.¿Qué puedo hacer con Histofix®-Safe?
Histofix®-Safe Se utiliza para la fijación de muestras histológicas y patológicas en un dispositivo de formalina sin contacto para el procesamiento y la preparación de biopsias para el análisis microscópico.¿Qué es Histofix®-Safe?
Histofix®-Safe es un contenedor cerrado utilizado en patología e histología que permite fijar muestras biológicas o biopsias de forma supersegura, evitando al máximo el contacto con el cancerígeno formaldehído.¿Qué líquido se utiliza en Histofix®-Safe?
Histofix®-Safe contiene formol diluido al 4%, tamponado y estabilizado con metanol listo para fijar muestras biológicas o biopsias para su análisis microscópico.¿De qué está hecho Histofix®-Safe?
El dispositivo Histofix®-Safe está fabricado con plásticos 100% reciclables como el polipropileno, lo que permite una eliminación de muestras respetuosa con el medio ambiente y un plástico recuperable.¿Cómo funciona el tapón Histofix®-Safe?
El tapón Histofix®-Safe es bidireccional y permite que el formol fluya de un recipiente al otro siempre que se ejerza presión sobre uno de los recipientes. Esto se consigue presionando el contenedor superior hasta que todo el líquido fluya hacia el contenedor inferior a través de la válvula bidireccional. La muestra se sumergirá en el formaldehído, iniciándose el proceso de fijación. Si no se ejerce presión, el formol no fluye de un recipiente al otro.¿Está patentado Histofix®-Safe?
Sí, el dispositivo Histofix Safe está patentado desde enero de 2021 (número de patente WO2021/016060A9).¿Dónde puedo comprar Histofix®-Safe?
Histofix®-Safe puede adquirirse a través de nuestra red de distribuidores en todo el mundo.¿Cuál es la ventaja del dispositivo Histofix®-Safe?
La principal ventaja del dispositivo Histofix®-Safe es que las muestras biológicas o biopsias se pueden fijar y transportar sin riesgo de inhalar o entrar en contacto con el vapor de formol. El dispositivo Histofix®-Safe también es fácil de almacenar y transportar, hecho de plástico reciclable, fácil de usar, intuitivo.¿Qué muestras puedo utilizar para Histofix®-Safe?
Se puede utilizar cualquier tipo de muestra biológica o biopsia que sea adecuada en términos de volumen. La muestra no debe ser demasiado grande porque debe caber dentro y debe haber suficiente formol para una fijación adecuada. Además, la muestra o biopsia no debe ser demasiado pequeña para que no pueda filtrarse a través de la rejilla.¿Qué volumen debo elegir?
El dispositivo Histofix®-Safe está disponible en tres tamaños de envase: 20 mL, 30 mL y 40 mL. La capacidad a elegir depende del volumen de la muestra biológica. El volumen de fijador debe ser proporcional al volumen de la muestra. En biopsias pequeñas, normalmente se puede utilizar un volumen de líquido 10 veces superior al volumen del tejido.¿Qué se entiende por tiempo de fijación?
El tiempo de fijación adecuado depende también del volumen de tejido y del tipo de muestra. En general, puede oscilar entre 6 horas para biopsias con aguja o endoscópicas y 24 horas para muestras quirúrgicas.¿El Histofix®-Safe lleva la marca CE IVD?
Sí, el dispositivo Histofix®-Safe lleva la marca CE IVD en cumplimiento del nuevo reglamento (UE) 2017/746 sobre productos de diagnóstico in vitro (IVDR) que sustituye a la antigua Directiva 98/79/CE.Literature
[1] SEAP-IAP, DOCUMENTO DE RECOMENDACIONES DE LA SOCIEDAD ESPAÑOLA DE ANATOMÍA PATOLÓGICA-IAP REFERENTE A LAS MEDIDAS DE SEGURIDAD ACONSEJADAS EN EL MANEJO DEL FORMALDEHÍD0 Y AL USO DE FIJADORES ALTERNATIVOS, Ángel Concha López, Ramiro Álvarez Alegret, Fina Autonell Reixach, Rocío Cabrera Pérez, Miguel Ángel Carrasco García, Ignacio Claros González, Sagrario García Sánchez , Javier Gómez Román, Teresa Hermida Romero, Teresa Hernández Iglesias, Antonio Martínez Lorente, Antonio Martínez Pozo, Beatriz Torio Sánchez, Enrique de Álava Casado.[2] Documentación de patente: WO2021/016060A9 28 de enero de 2021, EP3766579 - Contenedor para muestras biológicas, EP 3 766 579 A1 SOLICITUD DE PATENTE EUROPEA, WO2021016060 - Contenedor para muestras biológicas.








