Dimensioni confezioni (4)
| codice | dimensione imballaggio | prezzo per unità | prezzo confezione per unità | |
|---|---|---|---|---|
| Codice e imballaggio | Prezzo per articolo | |||

|
codice
258462.0955
|
dimensione imballaggio
50x20 ml
|
prezzo per unità
unico
153,80€
|
prezzo confezione per unità
|

|
codice
258462.0961
|
dimensione imballaggio
50x40 ml
|
prezzo per unità
unico
164,00€
|
prezzo confezione per unità
|

|
codice
258462.0962
|
dimensione imballaggio
50x30 ml
|
prezzo per unità
unico
158,90€
|
prezzo confezione per unità
|

|
codice
258462.1255
|
dimensione imballaggio
11x20 ml
|
prezzo per unità
unico
33,85€
|
prezzo confezione per unità
|
Dati tecnici
- Density:
- 1.019 kg/l
- Solubility:
- Miscible with water
- Physical Description:
- liquid
- Product Code:
- 258462
- Product Name:
- Histofix®-Safe Preservative ready to use (CE-IVD) for clinical diagnostics
- Quality Name:
- for clinical diagnostics
- Headline Comment:
- In Vitro Diagnostic medical device class A in compliance to the Regulation (EU) 2017/746
- Specifications:
- Assay (Iodom.): 3.7-4.0 %
pH: 6.8-7.2
Methanol (w/v): 1 - 1.5 %
- Pittogrammi di pericolo
-
- Storage:
- Room Temperature.
- Signal Word:
- Danger
- GHS Symbols:
- GHS08
GHS07
- H Phrases:
- H350
H317
H341
H302
- P Phrases:
- P201
P202
P261
P272
P280
P281
P302+P352
P308+P313
P321
P333+P313
P363
P405
P501
- Master Name:
- Histofix®-Safe Preservative ready to use
- CS:
- 38229000
Documenti
Richieste
Comments
IstologiaL'istologia è il settore della biologia che studia la composizione, la struttura e le caratteristiche dei tessuti organici degli esseri viventi. L'istologia è strettamente legata all'anatomia microscopica, poiché il suo studio non si ferma ai tessuti, ma va oltre, osservando anche le cellule e altri corpuscoli, ed è collegata alla biochimica, alla citologia e alla medicina.
L'istologia è diventata molto importante in medicina e biologia in quanto è cruciale per le seguenti discipline: biochimica, biologia molecolare e fisiologia da un lato e i processi patologici e le loro conseguenze dall'altro.
Le tecniche classiche di istologia sono applicate nei laboratori medici per la diagnosi di una grande varietà di malattie. Queste tecniche sono adeguate nella maggior parte dei casi diagnostici. Tuttavia, quando la diagnosi con queste tecniche classiche non può essere considerata affidabile, devono essere utilizzati metodi aggiuntivi. Queste tecniche includono la colorazione istochimica, metodi immunoistochimici, ibridazione del DNA, ibridazione in situ a fluorescenza (FISH), PCR, citometria a flusso ecc.
I laboratori medici di cui sopra si concentrano principalmente sulla scienza applicata basata sul numero di test diagnostici prodotti, al contrario dei laboratori di ricerca che si concentrano sulla scienza di base su base accademica.
Un laboratorio medico o laboratorio clinico è il luogo in cui i test vengono solitamente eseguiti su campioni clinici per ottenere informazioni sulla salute di un paziente in termini di diagnosi, trattamento e prevenzione delle malattie.
I laboratori di ricerca utilizzano tecniche convenzionali per le procedure di genomica, proteomica e coltura cellulare.
I prodotti a marchio PanReac AppliChem per i laboratori ospedalieri:
• Laboratori medici: Prodotti di microscopia.
• Laboratori di ricerca: Prodotti di genomica, proteomica e coltura cellulare.
Laboratori medici
In molti paesi ci sono principalmente due tipi di laboratori medici a seconda del tipo di ricerca effettuata.
• Laboratori ospedalieri: laboratori integrati in un ospedale per eseguire test sui campioni dei pazienti. Ci sono 4 diversi tipi di laboratori
• Laboratori di patologia clinica: ematologia, istopatologia, citologia, patologia di routine.
• Laboratori di microbiologia clinica: batteriologia, micobatteriologia, virologia, micologia, parassitologia, immunologia, sierologia.
• Laboratori di biochimica clinica: analisi biochimiche, test ormonali, ecc.
• Laboratorio di diagnostica molecolare o laboratorio di citogenetica e biologia molecolare.Laboratori clinici esterni: per test estremamente specializzati, il campione può andare a un laboratorio di ricerca esterno.
ITW Reagents offre una gamma completa di prodotti per istologia, ematologia e microbiologia con il marchio PanReac AppliChem, compresi i reagenti più comunemente usati nel processo di preparazione dei campioni per l'esame microscopico. Questa gamma copre tutte le fasi di fissazione, pulizia, inclusione in paraffina, colorazione e montaggio. I reagenti ITW hanno anche una vasta gamma di prodotti per la ricerca in diverse aree nelle Scienze della Vita per saggi da sviluppare nei laboratori ospedalieri: genomica, proteomica e coltura cellulare.
Molti dei prodotti a marchio PanReac AppliChem utilizzati in microscopia portano il marchio CE IVD in conformità al nuovo Regolamento europeo (UE) 2017/746 sui prodotti diagnostici in vitro (IVDR).
Tecniche e fasi del trattamento istologico
Sebbene la maggior parte delle fasi del trattamento istologico siano comuni, alcune di esse sono uniche per un singolo tipo di trattamento del campione. Ad esempio, l'inclusione viene eseguita solo sui tessuti e la fissazione termica solo sui campioni di sangue.
Tecniche e fasi di lavorazione istologica
Sebbene la maggior parte delle fasi del trattamento istologico siano comuni, alcune di esse sono uniche per un singolo tipo di trattamento del campione. Per esempio, l'embedding viene fatto solo sui tessuti e la fissazione a caldo solo sui campioni di sangue.
Le fasi più comuni e i prodotti utilizzati sono i seguenti:
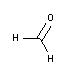
• Fissazione: La fissazione interrompe i processi di degradazione che avvengono dopo la morte cellulare, cercando di preservare il tessuto/architettura cellulare e la composizione il più vicino possibile a come era nell'organismo vivente. Il tipo più comune è la fissazione chimica con Formaldeide 3.7-4.0% w/v tamponata a pH=7 e stabilizzata con metanolo e, per una maggiore sicurezza, Histofix® Formaldeide monodose pronta all'uso.
• Disidratazione e pulizia: La disidratazione è la rimozione completa dell'acqua dal campione o dal tessuto in modo che possa essere correttamente incorporato nei successivi mezzi di incorporazione non solubili in acqua. I campioni fissati e lavati vengono passati in alcool al 96% e poi in alcool assoluto per un tempo variabile, in genere un'ora e mezza in ogni bagno. La chiarificazione è la sostituzione dell'agente essiccante con una sostanza miscibile con il mezzo di incorporazione da utilizzare. I prodotti più comuni in questa fase sono gli alcoli come l'etanolo assoluto, l'etanolo al 96%, l'etanolo al 70%, che possono essere denaturati o meno, così come lo xilene.
• Inclusione: con l'inclusione, l'acqua del tessuto viene sostituita da un mezzo liquido capace di solidificare in condizioni di temperatura adeguate. A questo scopo si utilizza la cera di paraffina P.F. 55-58°C plastificata + DMSO o semplicemente la cera di paraffina P.F. 56-58°C.
• Taglio: I tessuti inclusi in paraffina sono tagliati abbastanza sottili (4-6 micron) da permettere il passaggio della luce per l'esame al microscopio. Questo viene fatto con un microtomo: uno strumento meccanico usato per fare sezioni micrometriche di tessuto. Raccomandiamo il nostro pulitore di paraffina per mantenere pulito il microtomo.
• Disincrostazione-idratazione: La deceratura-idratazione è il processo di rimozione del mezzo di inclusione dalle sezioni di tessuto in paraffina e la loro reidratazione per una corretta penetrazione del colorante. I reagenti più comuni in questa fase sono gli alcoli come l'Etanolo assoluto, l'Etanolo 96%, l'Etanolo 70% che possono essere o meno denaturati oltre allo Xilene.
• Colorazione: La maggior parte dei tessuti, specialmente quelli di origine animale, sono incolori a meno che non contengano pigmenti. È quindi necessario colorarli per l'osservazione al microscopio. Ciò si ottiene usando coloranti, sostanze che, a contatto con un supporto adatto, si legano ad esso in modo durevole, trasmettendone il colore. I coloranti più usati sono l'ematossilina e l'eosina, ma esiste una grande varietà di coloranti a seconda del tessuto da colorare.
• Montaggio e immersione: Una volta che i preparati sono stati sciacquati, devono essere montati definitivamente. I mezzi di montaggio possono essere acquosi o non acquosi; il tipo utilizzato dipende dal relativo protocollo. Esempi di mezzi di montaggio sono DPX, Canada Balsam e Eukitt®. I mezzi di immersione sono liquidi, spesso oli naturali, che hanno un indice di rifrazione definito. È importante che l'indice di rifrazione sia circa 1,5 (lo stesso indice del vetro). Questo permette un'immersione omogenea dell'olio. A questo scopo, si usa l'olio d'immersione o l'olio di cedro.
• Analisi microscopica: Questa è la fase di osservazione microscopica. Non sono necessari altri reagenti.
FAQs
Che cos'è l'istologia?
L'istologia è una materia della Biologia/Medicina che studia la composizione, la struttura e le caratteristiche dei tessuti organici degli esseri viventi. L'istologia è strettamente correlata all'anatomia microscopica, in quanto il suo studio non si ferma ai tessuti, ma va oltre, osservando anche le cellule all'interno e altri corpuscoli, in relazione alla biochimica e alla citologia.Cosa si intende per fissazione in istologia?
Nel campo dell'istologia, della patologia e della biologia cellulare, la fissazione è la conservazione dei tessuti biologici dal deterioramento per autolisi o putrefazione. Essa blocca le reazioni biochimiche in corso e può anche aumentare la resistenza meccanica o la stabilità del tessuto trattato. La fissazione dei tessuti è una fase fondamentale della preparazione delle sezioni istologiche. L'obiettivo generale della fissazione è quello di preservare le cellule e i componenti del tessuto in modo da poter produrre sezioni sottili e colorate. Ciò consente di studiare la struttura del tessuto, che è determinata dalla forma e dalle dimensioni delle macromolecole (all'interno e intorno alle cellule), come le proteine e gli acidi nucleici.Che cos'è l'autolisi?
L'autolisi è la distruzione di cellule o tessuti da parte dei loro stessi enzimi, in particolare quelli rilasciati dai lisosomi.Cosa si intende per putrefazione?
La putrefazione è la decomposizione di cellule o tessuti ad opera dei loro stessi enzimi, in particolare quelli rilasciati dai lisosomi.La putrefazione è la decomposizione della materia organica, in particolare la scomposizione tipicamente anaerobica delle proteine da parte di batteri e funghi, con la formazione di prodotti maleodoranti incompletamente ossidati. Il processo di putrefazione è avviato dai batteri presenti nell'ambiente. Questi batteri decompongono la materia organica e producono prodotti di scarto come metano e ammoniaca. Questi gas fanno gonfiare l'oggetto ed emanano un odore sgradevole.
Che cos'è un mezzo di infiltrazione tissutale?
Un mezzo di infiltrazione tissutale è una speciale formulazione di paraffina purificata e polimeri plastici per infiltrare o incorporare il campione biologico.Come si rimuove l'acqua da un campione di tessuto/biopsia?
Questo processo viene comunemente eseguito immergendo i campioni in una serie di soluzioni di etanolo (alcool) a concentrazione crescente fino a ottenere un alcool puro e privo di acqua. L'etanolo è miscibile con l'acqua in tutte le proporzioni, per cui l'acqua presente nel campione viene progressivamente sostituita dall'alcol.Quali solventi posso utilizzare per la rimozione dell'acqua da campioni di tessuto/biopsie in istologia/patologia?
Etanolo assoluto, etanolo al 96%, etanolo al 70% sono i solventi più comunemente utilizzati. Poiché la paraffina fusa è idrofobica (immiscibile con l'acqua), la maggior parte dell'acqua presente in un campione deve essere rimossa prima di poter essere infiltrata con la paraffina. Questo processo viene solitamente eseguito immergendo i campioni in una serie di soluzioni di etanolo (alcool) a concentrazione crescente fino a ottenere alcool puro senza acqua. L'etanolo è miscibile con l'acqua in tutte le proporzioni, per cui l'acqua presente nel campione viene progressivamente sostituita dall'alcol. Si utilizza una serie di concentrazioni crescenti di alcol per evitare un eccessivo deterioramento del tessuto.Cosa si intende per serie graduale di disidratazione nella preparazione delle biopsie istologiche?
La disidratazione è il processo di rimozione completa dell'acqua dal tessuto fissato. Per la disidratazione si utilizzano concentrazioni graduali di etanolo; il tessuto viene immerso in etanolo al 70% in acqua, seguito da soluzioni al 96% e al 100%. L'etanolo garantisce una disidratazione completa e rappresenta il reagente preferito per il trattamento dei campioni di microscopia elettronica. Per i tessuti delicati, si raccomanda di iniziare il trattamento con etanolo al 30%. I disidratanti devono essere solubili in acqua e l'etanolo è l'agente disidratante più comunemente usato. L'etanolo ha diverse proprietà speciali per la disidratazione: completa miscibilità con l'acqua, effetto irrigidente, elevato potere disidratante e permeabilità dei tessuti. Per evitare un eccessivo irrigidimento del tessuto, è spesso necessario utilizzare etanolo graduato (di solito in concentrazioni successive di 70%, 80%, 95% ed etanolo assoluto) per sostituire gradualmente l'acqua nel tessuto. Anche l'isopropanolo può essere utilizzato in sostituzione dell'EtOH, ma con modifiche al protocollo di disidratazione standard. A seconda delle dimensioni o del tipo di campioni, il tempo di permanenza in isopropanolo graduato deve essere ottimizzato. I campioni molto piccoli possono indurirsi eccessivamente, mentre i campioni grassi o più grandi necessitano di una maggiore disidratazione. L'isopropanolo non si mescola con la paraffina, quindi sarà necessario utilizzare un agente chiarificante come lo xilene.Che cos'è la microscopia in campo chiaro?
La microscopia in campo chiaro (BF) è il metodo di illuminazione più semplice della microscopia ottica. Il campione viene transilluminato con luce bianca (cioè illuminato dal basso e visto dall'alto) e il contrasto del campione è dovuto all'attenuazione della luce trasmessa nelle aree dense del campione. La microscopia in campo chiaro è la più semplice delle tecniche utilizzate per illuminare i campioni nei microscopi ottici e la sua semplicità la rende una tecnica molto popolare. L'aspetto tipico di un'immagine di microscopia in campo chiaro è quello di un campione scuro su uno sfondo chiaro, da cui il nome.Cosa si intende per disidratazione in istologia?
La disidratazione è il processo di rimozione completa dell'acqua dai tessuti fissati. Per la disidratazione si utilizzano concentrazioni graduali di etanolo; il tessuto viene immerso in etanolo al 70% in acqua, seguito da soluzioni al 96% e al 100%. La maggior parte dei mezzi di infiltrazione (la matrice solida di supporto per il taglio dei campioni di tessuto) sono idrofobici, quindi è necessario rimuovere l'acqua dai tessuti prima dell'ulteriore elaborazione. Esistono due metodi generali per disidratare i tessuti. Il metodo più comune è la sostituzione graduale dell'acqua con un solvente organico trasportando il tessuto attraverso soluzioni a concentrazione crescente (etanolo, acetone), chiamata serie di disidratazione graduata. Un metodo meno comune nella microscopia in campo chiaro è la disidratazione rapida con un reagente organico (2-metossiacetato di etile, dimetossipropano, trietilfosfato). La disidratazione rapida sostituisce rapidamente l'acqua nel tessuto senza danneggiare la tensione superficiale, come può accadere con alcoli o acetone. L'acetato di etile 2-metossi e il propano dimetossi presentano regioni idrofile e idrofobe. Ciò consente al solvente di interagire con i lipidi della membrana biologica senza distruggerli. La disidratazione risultante avviene attraverso un meccanismo di flusso di massa piuttosto che attraverso una reazione chimica. Il vantaggio relativo di ciascun metodo è soggettivo e dipende dai tessuti coinvolti e dalle preferenze personali. In passato, la disidratazione rapida era limitata alle procedure di infiltrazione di plastica, ma può certamente essere utilizzata con le tecniche di paraffina.Cosa si intende per colorazione in istologia?
Una colorazione o un colorante è un ausilio utilizzato in microscopia per aumentare il contrasto dell'immagine vista al microscopio. I coloranti sono sostanze comunemente utilizzate in biologia e medicina per evidenziare le strutture dei tessuti biologici da osservare con diversi tipi di microscopio. I diversi coloranti possono essere utilizzati per rendere più nitide ed esaminare ampie sezioni di tessuto (ad esempio, per evidenziare le fibre muscolari o il tessuto connettivo), per evidenziare le popolazioni cellulari (ad esempio, per classificare le diverse cellule del sangue) o anche per evidenziare gli organelli all'interno delle singole cellule. In biochimica, significa aggiungere un colorante specifico (che si lega selettivamente a DNA, proteine, lipidi, carboidrati, ecc.) a un substrato per qualificare o quantificare la presenza di un particolare composto. Sia la colorazione che l'etichettatura fluorescente possono servire allo stesso scopo. Diversi tipi di coloranti biologici sono utilizzati anche per etichettare le cellule nella citometria a flusso e per etichettare le proteine o gli acidi nucleici nell'elettroforesi su gel.Quali sono i tipi di colorazione in istopatologia?
Possiamo trovare diversi tipi di colorazioni a seconda del tipo di diagnosi come Ematossilina ed Eosina, Macchia di Gram, Macchia di Giemsa, Reazione Periodica dell'Acido di Schiff, Tricromia di Masson, Rosso Congo, Blu di Prussia, Mucicarmina, Olio di Sudan Nero, Rosso O, Macchia d'Argento, Macchia di Nissl, Macchia di Papanicolaou.Qual è il metodo di colorazione più comune?
La colorazione di routine con ematossilina ed eosina (H&E). È la colorazione istologica più comune, utilizzata per differenziare le diverse strutture tissutali. Svolge inoltre un ruolo importante nella diagnosi di varie patologie.Cosa si intende per "clearance" in istologia?
La schiaritura è una fase essenziale del trattamento istopatologico per la microscopia ottica. Lo scopo della detersione è rimuovere gli agenti disidratanti (etanolo) dai tessuti e prepararli all'impregnazione con l'agente di inclusione (paraffina). Lo xilene è l'agente di pulizia più utilizzato in tutto il mondo.Che cos'è una biopsia?
Una biopsia è un campione di tessuto prelevato dal corpo per ulteriori esami. Il medico consiglia una biopsia quando un primo esame indica che un'area di tessuto del corpo non è normale. I medici si riferiscono a un'area di tessuto anormale come a una lesione, un tumore o una massa. Si tratta di termini generici che sottolineano la natura sconosciuta del tessuto. L'area sospetta può essere scoperta durante un esame fisico o internamente durante un test di imaging.Che cos'è un campione biologico in istologia?
In istologia, un campione biologico è un materiale come urina, sangue, tessuto, cellule, DNA, RNA o proteine provenienti da esseri umani, animali o piante. I campioni biologici vengono utilizzati per i test di laboratorio o conservati in un deposito biologico per uso di ricerca.Qual è il flusso di lavoro comune in istologia?
Il flusso di lavoro comune nel laboratorio di istologia consiste nelle fasi principali che un campione biologico o una biopsia attraversano dal prelievo del campione all'esame microscopico. Questo flusso di lavoro comprende le seguenti fasi: fissazione, asciugatura, pulizia, colorazione, inclusione e montaggio.Quali colorazioni si usano in istologia?
Le colorazioni più comunemente utilizzate in istologia sono le seguenti: Coloranti di routine: Ematossilina ed Eosina; Coloranti speciali: Van Gieson, Blu di Toluidina, Blu di Alcian, Giemsa, Reticolina, Nissl, Orceina, Nero Sudan B. Tricromia di Masson, Tricromia di Mallory, Tricromia di Azan, Tricromia di Cason, Acido periodico di Schiff, Resorcina di Weigert e Fuchsina.Come si fissa una biopsia?
Una biopsia può essere fissata con formaldeide o formalina. Questo processo è chiamato fissazione. Lo scopo della formaldeide o della formalina è quello di fissare il tessuto per bloccare i cambiamenti autolitici nelle biopsie. Tutti i campioni devono essere posti immediatamente dopo l'asportazione in formalina neutra tamponata al 10% per consentire la "fissazione". Idealmente, la quantità di fissativo dovrebbe essere almeno dieci volte il volume del campione.Qual è la differenza tra formaldeide e formalina?
?In sostanza, la formaldeide è un gas incolore, solubile in acqua, infiammabile a temperatura ambiente e dall'odore pungente e irritante. La formalina, invece, è un liquido che si prepara mescolando il gas formaldeide e l'acqua. Questa è la principale differenza tra formalina e formaldeide. In genere, una soluzione satura di formalina contiene circa il 40% (in volume) o il 37% (in peso) di formaldeide gassosa e uno stabilizzatore che impedisce la polimerizzazione della formaldeide.La formaldeide è cancerogena?
La formaldeide è uno dei più comuni agenti cancerogeni. La formaldeide è una delle sostanze più accuratamente valutate. Nel 2014 la formaldeide è stata riclassificata come cancerogeno di categoria 1B. La nuova classificazione è entrata in vigore nel giugno 2014 con la pubblicazione nella Gazzetta ufficiale dell'Unione europea (REGOLAMENTO (UE) N. 605/2014 DELLA COMMISSIONE del 5 giugno 2014).Perché si usa l'etanolo in istologia?
In istologia, l'etanolo viene utilizzato come agente disidratante e reidratante. La disidratazione serve a preparare il campione da incorporare nella paraffina e a rimuovere la paraffina con l'uso dello xilene come solvente intermedio. Lo xilene non è miscibile con l'acqua. L'etanolo al 96% contiene una parte di acqua. Pertanto, l'etanolo assoluto deve essere utilizzato come "ponte" tra lo xilene e l'etanolo al 96%.Perché si usa lo xilene in istologia?
In istologia, lo xilene viene utilizzato per la lavorazione e la colorazione dei tessuti. Lo xilene è preferito per la lavorazione dei tessuti perché li rende trasparenti in modo che la paraffina possa ricoprirli completamente. Quando si preparano i vetrini per la microscopia, lo xilene può rimuovere eventuali residui di paraffina dai vetrini.Cos'è la tecnica della paraffina?
In istologia e patologia, applicando la tecnica della paraffina, le biopsie vengono fissate e incorporate nella cera. In questo modo il tessuto si indurisce e diventa molto più facile tagliare sezioni di tessuto al microtomo. Le sezioni vengono poi colorate ed esaminate al microscopio ottico.Cosa significa Histofix®?
?Histofix® è il marchio di ITW Reagents per tutti i prodotti relativi alla fissazione dei campioni istologici. Tra questi, la formaldeide per la fissazione di biopsie normali, la formaldeide rosa per la fissazione di biopsie minuscole e i decalcificanti per la fissazione delle ossa.Cosa posso fare con Histofix®-Safe?
?Histofix®-Safe è utilizzato per la fissazione di campioni istologici e patologici in un dispositivo di formalina senza contatto per la lavorazione e la preparazione di biopsie per l'analisi al microscopio.Cos'è Histofix®-Safe?
?Histofix®-Safe è un contenitore chiuso utilizzato in patologia e istologia che consente di fissare campioni biologici o biopsie in modo super-sicuro, evitando il più possibile il contatto con la formaldeide, sostanza cancerogena.Quale liquido viene utilizzato in Histofix®-Safe?
?Histofix®-Safe contiene formalina diluita al 4%, tamponata e stabilizzata con metanolo, pronta per fissare campioni biologici o biopsie per analisi al microscopio.Di cosa è fatto Histofix®-Safe?
?Il dispositivo Histofix®-Safe è realizzato con plastiche riciclabili al 100%, come il polipropilene, che consentono uno smaltimento ecologico dei campioni e il recupero della plastica.Come funziona il tappo Histofix®-Safe?
?Il tappo Histofix®-Safe è bidirezionale e permette alla formalina di fluire da un contenitore all'altro quando si esercita una pressione su uno dei contenitori. Ciò si ottiene premendo il contenitore superiore finché tutto il liquido non fluisce nel contenitore inferiore attraverso la valvola bidirezionale. Il campione viene immerso nella formaldeide, dando inizio al processo di fissazione. Se non si esercita pressione, la formaldeide non fluisce da un contenitore all'altro.Histofix®-Safe è brevettato?
?Sì, il dispositivo Histofix Safe è brevettato dal gennaio 2021 (numero di brevetto WO2021/016060A9).Dove posso acquistare Histofix®-Safe?
?Histofix®-Safe è disponibile attraverso la nostra rete di distributori in tutto il mondo.Quali sono i vantaggi del dispositivo Histofix®-Safe?
?Il vantaggio principale del dispositivo Histofix®-Safe è che i campioni biologici o le biopsie possono essere fissati e trasportati senza il rischio di inalare o entrare in contatto con i vapori di formalina. Il dispositivo Histofix®-Safe è anche facile da conservare e trasportare, è realizzato in plastica riciclabile, è facile da usare e intuitivo.Quali campioni posso utilizzare per Histofix®-Safe?
È possibile utilizzare qualsiasi tipo di campione biologico o bioptico che sia adatto in termini di volume. Il campione non deve essere troppo grande perché deve entrare e deve esserci abbastanza formalina per una fissazione adeguata. Inoltre, il campione o la biopsia non devono essere troppo piccoli, in modo che non possano fuoriuscire dalla griglia.Quale volume devo scegliere?
?Il dispositivo Histofix®-Safe è disponibile in tre formati di contenitore: 20 mL, 30 mL e 40 mL. La capacità da scegliere dipende dal volume del campione biologico. Il volume del fissativo deve essere proporzionale al volume del campione. Per le biopsie di piccole dimensioni si può normalmente utilizzare un volume di liquido pari a 10 volte il volume del tessuto.Cosa si intende per tempo di fissazione?
Il tempo di fissazione appropriato dipende anche dal volume del tessuto e dal tipo di campione. In generale, può variare da 6 ore per le biopsie con ago o endoscopiche a 24 ore per i campioni chirurgici.Il dispositivo Histofix®-Safe ha il marchio CE IVD?
Sì, il dispositivo Histofix®-Safe ha il marchio CE IVD. Sì, il dispositivo Histofix®-Safe porta il marchio CE IVD in conformità al nuovo regolamento (UE) 2017/746 sui dispositivi diagnostici in vitro (IVDR) che sostituisce la vecchia direttiva 98/79/CE".Literature
[1] SEAP-IAP, DOCUMENTO DE RECOMENDACIONES DE LA SOCIEDAD ESPAÑOLA DE ANATOMÍA PATOLÓGICA-IAP REFERENTE A LAS MEDIDAS DE SEGURIDAD ACONSEJADAS EN EL MANEJO DEL FORMALDEHÍD0 Y ALO USO DE FIJADORES ALTERNATIVOS, Ángel Concha López, Ramiro Álvarez Alegret, Fina Autonell Reixach, Rocío Cabrera Pérez, Miguel Ángel Carrasco García, Ignacio Claros González, Sagrario García Sánchez , Javier Gómez Román, Teresa Hermida Romero, Teresa Hernández Iglesias, Antonio Martínez Lorente, Antonio Martínez Pozo, Beatriz Torio Sánchez, Enrique de Álava Casado.[2] Documentazione brevettuale: WO2021/016060A9 28 gennaio 2021, EP3766579 - Contenitore per campioni biologici, EP 3 766 579 A1 EUROPEAN PATENT APPLICATION, WO2021016060 - Contenitore per campioni biologici








