Comments
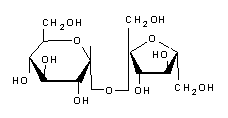
La sacarosa o saccarosa es un azúcar de sabor dulce. Se extrae de ciertas plantas, especialmente de la caña de azúcar y la remolacha azucarera, y se utiliza ampliamente en la alimentación humana. Se trata de un diholósido compuesto por glucosa y fructosa, cuya denominación normalizada es α-D-glucopiranósido-(1↔2)-β-D-fructofurósido, habitualmente abreviado como Glc-Fru. En inglés se conoce como sucrose, de ahí la abreviatura Suc para este compuesto que a veces se encuentra en la literatura. - Los hidratos de carbono, especialmente la sacarosa, solían llamarse carbohidratos debido a un antiguo experimento sobre la deshidratación del azúcar blanco con ácido sulfúrico concentrado, en el que la sacarosa con la fórmula molecular C12H22O11 se descomponía en agua H2O y negro de humo. De ello se había deducido erróneamente que la fórmula de la sacarosa podía escribirse (H2O)11C12, lo que correspondería a un hidrato de carbono. El término quedó obsoleto gracias a los trabajos de Walter Norman Haworth, que estableció la estructura de los hidratos de carbono a principios del siglo XX, y desde entonces ha caído en desuso. Sin embargo, en el mundo anglosajón, el término sigue utilizándose. - Propiedades - Estructura - La molécula de sacarosa es un diholósido formado por un residuo de glucosa y otro de fructosa unidos por un enlace α(1↔2)β. Su fórmula molecular es C12H22O11 y su masa molar es de 342,3 g mol-1. A diferencia de la mayoría de los otros diholósidos, la sacarosa se forma mediante la unión de dos osos en sus extremos reductores, lo que la convierte en un azúcar no reductor. Además, sólo el anómero α de la glucopiranosa y el anómero β de la fructofuranosa forman la sacarosa. - La sacarosa cristaliza en el sistema cristalino monoclínico según el grupo espacial P21 con parámetros cristalinos a = 1,086 31 nm, b = 0,870 44 nm, c = 0,776 24 nm y β = 102,938° - La pureza de la sacarosa se mide polarimétricamente. Más concretamente, se mide la rotación del plano de polarización de la luz polarizada que atraviesa una solución acuosa de azúcar. La rotación específica (en) a 20 °C, medida con la línea D de sodio a 589 nm, es de +66,47°. La sacarosa comercial se controla de esta manera. No se deteriora en condiciones normales. - La sacarosa tiene cinco isómeros naturales que difieren en la posición del enlace osídico: Trehalulosa ⇒ glucosa α(1→1) fructosa ; Turanosa ⇒ glucosa α(1→3) fructosa (diholósido reductor) ; Maltosa ⇒ glucosa α(1→4) fructosa ; Leucrosa ⇒ Glucosa α(1→5) Fructosa (diholósido reductor) ; Isomaltulosa (Palatinosa) ⇒ Glucosa α(1→6) Fructosa (diholósido reductor). - Reacciones con la sacarosa - Son concebibles varias transformaciones químicas con la sacarosa como reactivo: - Descomposición térmica - La descomposición térmica de la sacarosa puede representarse como una reacción en dos etapas: -primero, deshidratación (por el ácido sulfúrico H2SO4), produciendo agua y hollín: - C12H22O11 → 12 C + 11 H2O ; -y luego oxidación (con el oxígeno del aire) del carbono a dióxido de carbono : - 12 C + 12 O2 → 12 CO2. - Caramelización: la sacarosa no se funde al calentarse, sino que se descompone en caramelo a unos 186 °C. - Combustión - La sacarosa se quema en una reacción exotérmica para formar agua y dióxido de carbono, como hacen todos los hidratos de carbono. - Con el ácido clórico - Con el ácido clórico HClO3, la sacarosa libera agua, dióxido de carbono y cloruro de hidrógeno (HCl) : - 8 HClO3 + C12H22O11 → 11 H2O + 12 CO2 + 8 HCl. - Propiedades químicas - La sacarosa es un azúcar no reductor, el carbono hemiacetal de la glucosa y el carbono hemiacetal de la fructosa participan en el enlace osídico. No es higroscópico y no puede sufrir mutaciones. - Hidrólisis - La hidrólisis de la sacarosa provoca la ruptura del enlace osídico, liberando glucosa y fructosa en cantidades equimolares. Sin embargo, esta reacción es tan lenta que una solución acuosa de sacarosa puede permanecer prácticamente estable durante años. En cambio, en presencia de una sacarasa (sacarasa-isomaltasa, invertasa, sacarosa-alfa-glucosidasa) o de un ácido como el bitartrato de potasio HOOC-CHOH-CHOH-COOK o el zumo de limón, que son ácidos débiles, se procede mucho más rápidamente. Lo mismo ocurre en el jugo gástrico, que interviene en la digestión hidrolizando carbohidratos como la sacarosa. - La acción de la invertasa sobre la sacarosa produce el azúcar invertido, que consiste en cantidades iguales de glucosa y fructosa. - Biosíntesis de la sacarosa - La biosíntesis de la sacarosa es llevada a cabo por la sacarosa fosfato sintasa a partir de UDP-glucosa y fructosa-6-fosfato. La energía necesaria para esta reacción proviene de la escisión del UDP. La sacarosa es producida por las plantas y las cianobacterias, pero no por otros organismos vivos. Se encuentra de forma natural, junto con la fructosa, en muchas plantas consumidas en la dieta humana. Es el principal hidrato de carbono de muchas frutas, como las piñas y los albaricoques; otras frutas, como las peras y las uvas, tienen la fructosa como principal hidrato de carbono. - La síntesis completa de la sacarosa fue lograda por el químico canadiense Raymond Lemieux en 1953. - Propiedades físicas - la sacarosa carameliza a 160 °C. - La sacarosa es muy soluble en agua. La solubilidad de la sacarosa en disolventes no acuosos suele ser menor. Además, la sacarosa no es soluble en disolventes no polares. Se obtienen valores elevados con amoníaco condensado (72 %), dimetilsulfóxido (42 %) y metilamina (> 25 %). Los valores más bajos se obtienen con dióxido de azufre líquido, ácido fórmico y acético, dimetilformamida, piridina (6 %), propilenglicol, glicerol (7 %), metanol, etanol, acetona y dioxano. - El contenido de azúcar se indica mediante el grado Brix (que corresponde al porcentaje de masa a 20 °C). La concentración de una solución acuosa puede determinarse midiendo la densidad con un mosímetro o el índice de refracción con un refractómetro. - Propiedades edulcorantes - El poder edulcorante de la sacarosa sirve como valor de referencia en la escala de edulcorantes, es decir, se toma convencionalmente como 1. El límite de detección medio de la sacarosa es de 0,017 mol l-1 (5,82 g/litro). - Fuentes de sacarosa - En la naturaleza, la sacarosa se encuentra en una gran variedad de plantas, especialmente en sus raíces, frutos y néctar, donde se utiliza para almacenar la energía de la fotosíntesis. Muchos mamíferos, aves, insectos y bacterias se alimentan de la sacarosa de las plantas, algunos incluso como alimento principal. En este sentido, las abejas desempeñan un papel especial en la alimentación humana, ya que producen miel a partir del néctar, que se consume en todas las partes del mundo. Sin embargo, los azúcares de la miel son predominantemente glucosa y fructosa, con sólo trazas de sacarosa. A medida que las frutas maduran, el contenido de sacarosa suele aumentar muy rápidamente, pero también hay frutas que casi no contienen sacarosa. Algunos ejemplos son las uvas, las cerezas, los arándanos, las moras, los higos, las granadas, los tomates, los aguacates, los limones y las limas. - Uso en la industria alimentaria - el azúcar como importante ingrediente alimentario - la sacarosa es uno de los ingredientes más utilizados en la industria alimentaria. Constituye la base de ciertas industrias como la de la confitería, la panadería, la mermelada y las bebidas. - En la industria farmacéutica se utiliza como excipiente. - Química física - La sacarosa es muy soluble en agua, y su solubilidad aumenta con la temperatura. Es relativamente estable, pero puede fermentar (una evolución generalmente indeseable, salvo en las bebidas alcohólicas) o hidrolizarse en glucosa y fructosa (en el lenguaje de la confitería: invertido), aunque este fenómeno puede controlarse. - Cuando se utiliza en la industria de las bebidas, la sacarosa puede invertirse por sí misma durante el tratamiento térmico. Además, como el azúcar invertido es más soluble que la sacarosa, puede actuar como aglutinante de agua en su presencia y evitar que la sacarosa se cristalice. - La sacarosa reduce la actividad del agua de los productos que contienen mucha sacarosa, lo que permite su conservación. - También puede utilizarse como ayuda a la textura gracias a sus propiedades aglomerantes. - Granulometría - Diferentes tamaños de cristal según las necesidades de la industria: azúcar granulado; azúcar couleur; azúcar glas; azúcar granulado. - Uso en la fermentación - La sacarosa es uno de los sustratos de fermentación más clásicos. Muchos microorganismos pueden fermentarlo, incluido el altamente desarrollado Saccharomyces cerevisiae. - Uso en la agricultura - La sacarosa se utiliza en la agricultura. La pulverización de dosis muy pequeñas de azúcares solubles en los huertos tiene un efecto repelente de insectos al alterar la percepción de la planta por parte de las plagas.
FAQs
¿Qué es la sacarosa?
"La D(+)-sacarosa o azúcar común, es un disacárido formado por glucosa y fructosa, dos azúcares simples o monosacáridos. El enlace que une los dos monosacáridos es de tipo O-glucosídico, dicho enlace es dicarbonílico ya que son los dos carbonos reductores de ambos monosacáridos los que forman el enlace alfa(1-2) de alfa-D-glucosa y beta-D-fructosa. Se conoce comúnmente como azúcar, sacarosa o sucrosa, o por las siguientes denominaciones químicas: beta-D-fructofuranosil-alfa-D-glucopiranósido (nombre IUPAC), alfa-D-glucopiranosil-beta-D-fructofuranósido, α-D-glucopiranosil-(1→2)-β-D-fructofuranósido; β-D-fructofuranosil-(2→1)-α-D-glucopiranósido; β-(2S,3S,4S,5R)-fructofuranosil-α-(1R,2R,3S,4S,5R)-glucopiranósido; α-(1R,2R,3S,4S,5R)-glucopiranosil-β-(2S,3S,4S,5R)-fructofuranósido; ((2R,3R,4S,5S,6R)-2-[(2S,3S,4S,5R)-3,4-dihidroxi-2,5-bis(hidroximetil)oxapent-2-il]oxi-6-(hidroximetil)oxahexano-3,4,5-triol). La fórmula molecular de la D(+)-sacarosa es C12H22O11. Se obtiene principalmente de la caña de azúcar y de la remolacha azucarera. La sacarosa no posee carácter reductor debido a que no contiene ningún átomo de carbono anomérico libre, los carbonos anoméricos están unidos entre sí (ambos grupos OH de los carbonos carbonilos participan en el enlace O-glucosídico), es decir, el enlace glucosídico de la sacarosa se forma entre los extremos reductores de la glucosa y la fructosa, y no entre el extremo reductor de una y el extremo no reductor de la otra. Por lo tanto, al no tener carácter reductor, la sacarosa da negativo en la prueba de Fehling. La sacarosa es ópticamente activa. La actividad óptica es la propiedad de una sustancia para hacer girar el plano de luz polarizada. La sacarosa hace rotar el plano de polarización en el sentido de las manecillas del reloj (sentido horario), por lo que se le denomina azúcar dextrorrotatorio o déxtrógiro (+). La nomenclatura D-L proporciona una abreviatura rápida para designar los enantiómeros. Estos compuestos poseen dos formas estereoisómeras y se designan con las letras D- y L-, delante del nombre del compuesto, pero no se debe confundir con la nomenclatura relativa a la clasificación de los enantiómeros en formas dextrógira (+) y levógira (-), la cual hace referencia a la actividad óptica. La sacarosa, aparte de ser el edulcorante natural por excelencia de la alimentación humana, es el azúcar más utilizado por la industria farmacéutica para la elaboración de jarabes, comprimidos masticables, grageas, tabletas, etc. Los jarabes contienen sacarosa en una alta proporción, no sólo para lograr dulzura y viscosidad, sino para aumentar su estabilidad frente a microorganismos por la falta de disponibilidad de agua. Las altas concentraciones de azúcar hace que la elevada presión osmótica del jarabe impida el crecimiento bacteriano. La sacarosa es también un excipiente en vacunas. Como las vacunas son preparados biológicos, pueden ser inestables una vez creadas. Esta inestabilidad puede reducir la seguridad y la eficacia del producto biológico, las vacunas pueden ser sensibles al calor, la luz o los cambios en el entorno. La sacarosa mantiene la eficacia de las vacunas al impedir que las moléculas pierdan su forma en el proceso de fabricación, almacenamiento, distribución y, finalmente, cuando se administran a los pacientes. En la industria alimentaria, los azúcares en general, actúan como edulcorantes, potenciadores del sabor, antioxidantes y conservantes. Las reacciones químicas de los azúcares incluyen las reacciones de Maillard o la formación de compuestos pardos y caramelización. La sacarosa, en particular, actúa como estabilizador debido a sus propiedades humectantes naturales. Se utiliza como un producto multifuncional ya que, no sólo endulza los alimentos, sino que también ayuda a que éstos, especialmente los productos de panadería y pastelería, se mantengan frescos y conserven su humedad; favorece la fermentación en el pan y otros productos que contienen levadura, mejora el sabor y la textura de alimentos en general, es utlizado también como conservante y edulcorante en zumos, bebidas carbonatadas, refrescos y bebidas alcohólicas. Como cualquier otro soluto, la adición de azúcar a una mezcla modifica el punto de ebullición y congelación de la misma. Por ejemplo, en la fabricación de helados, los azúcares reducen el punto de congelación, evitando que el agua presente en el interior del helado se convierta en hielo, de esta forma se consigue una textura suave y apta para trabajarlo a pesar de las bajas temperaturas. En cambio, para la fabricación de caramelos, el aumento del punto de ebullición es el factor determinante de la textura del producto final. En general, a temperaturas más altas (mayor concentración de azúcar) quedan caramelos más duros y rígidos, mientras que las temperaturas más bajas producen caramelos más blandos. La textura final de un caramelo dependerá de la concentración de azúcar que a su vez depende del punto de ebullición." ¿Por qué la sacarosa no tiene poder reductor?
La sacarosa no posee carácter reductor debido a que no contiene ningún átomo de carbono anomérico libre, los carbonos anoméricos están unidos entre sí (ambos grupos OH de los carbonos carbonilos participan en el enlace O-glucosídico), es decir, el enlace glucosídico de la sacarosa se forma entre los extremos reductores de la glucosa y la fructosa, y no entre el extremo reductor de una y el extremo no reductor de la otra. Por lo tanto, al no tener carácter reductor, la sacarosa da negativo en la prueba de Fehling. El carácter reductor se da en un disacárido si uno de los monosacáridos que lo forman tiene su carbono anomérico (o carbonílico) libre, es decir, si este carbono no forma parte del enlace O-glucosídico. Dicho de otra forma, si el enlace O-glucosídico es monocarbonílico el disacárido resultante será reductor (lactosa, maltosa), mientras que si el enlace O-glucosídico es dicarbonílico el disacárido resultante será no reductor (sacarosa, trehalosa). El ensayo de Fehling (descubierto por el químico alemán Hermann von Fehling) se utiliza para la detección de sustancias reductoras, particularmente azúcares reductores. Se basa en el poder reductor del grupo carbonilo de un aldehído que pasa a ácido reduciendo la sal cúprica de cobre (II), en medio alcalino, a óxido de cobre (I). Éste forma un precipitado de color rojo. Un aspecto importante de esta reacción es que la forma aldehído puede detectarse fácilmente, aunque exista en muy pequeña cantidad. Si un azúcar reduce el reactivo de Fehling a óxido de cobre (I) rojo, se dice que es un azúcar reductor. Fehling (azul) + azúcar no reductor = color azul - Fehling (azul) + azúcar reductor = color rojo ladrillo ¿Para qué sirve la prueba de Fehling?
La prueba de Fehling (descubierta por el químico alemán Hermann von Fehling) se utiliza para la detección de sustancias reductoras, particularmente azúcares reductores. Se basa en el poder reductor del grupo carbonilo de un aldehído que pasa a ácido reduciendo la sal cúprica de cobre (II), en medio alcalino, a óxido de cobre (I). Éste forma un precipitado de color rojo. Un aspecto importante de esta reacción es que la forma aldehído puede detectarse fácilmente, aunque exista en muy pequeña cantidad. Si un azúcar reduce el reactivo de Fehling a óxido de cobre (I) rojo, se dice que es un azúcar reductor. Fehling (azul) + azúcar no reductor = color azul ; Fehling (azul) + azúcar reductor = color rojo ladrillo ¿Qué aplicaciones tiene la sacarosa?
La sacarosa, aparte de ser el edulcorante natural por excelencia de la alimentación humana, es el azúcar más utilizado por la industria farmacéutica para la elaboración de jarabes, comprimidos masticables, grageas, tabletas, etc. Los jarabes contienen sacarosa en una alta proporción, no sólo para lograr dulzura y viscosidad, sino para aumentar su estabilidad frente a microorganismos por la falta de disponibilidad de agua. Las altas concentraciones de azúcar hace que la elevada presión osmótica del jarabe impida el crecimiento bacteriano. La sacarosa es también un excipiente en vacunas. Como las vacunas son preparados biológicos, pueden ser inestables una vez creadas. Esta inestabilidad puede reducir la seguridad y la eficacia del producto biológico, las vacunas pueden ser sensibles al calor, la luz o los cambios en el entorno. La sacarosa mantiene la eficacia de las vacunas al impedir que las moléculas pierdan su forma en el proceso de fabricación, almacenamiento, distribución y, finalmente, cuando se administran a los pacientes. En la industria alimentaria, los azúcares en general, actúan como edulcorantes, potenciadores del sabor, antioxidantes y conservantes. Las reacciones químicas de los azúcares incluyen las reacciones de Maillard o la formación de compuestos pardos y caramelización. La sacarosa, en particular, actúa como estabilizador debido a sus propiedades humectantes naturales, se utiliza como un producto multifuncional ya que, no sólo endulza los alimentos, sino que también ayuda a que éstos, especialmente los productos de panadería y pastelería, se mantengan frescos y conserven su humedad; favorece la fermentación en el pan y otros productos que contienen levadura, mejora el sabor y la textura de alimentos en general y también como conservante y edulcorante en zumos, bebidas carbonatadas, refrescos y bebidas alcohólicas. Como cualquier otro soluto, la adición de azúcar a una mezcla modifica el punto de ebullición y congelación de la misma. Por ejemplo, en la fabricación de helados, los azúcares reducen el punto de congelación, evitando que el agua presente en el interior del helado se convierta en hielo, de esta forma se consigue una textura suave y apta para trabajarlo a pesar de las bajas temperaturas. En cambio, para la fabricación de caramelos, el aumento del punto de ebullición es el factor determinante de la textura del producto final. En general, a temperaturas más altas (mayor concentración de azúcar) quedan caramelos más duros y rígidos, mientras que las temperaturas más bajas producen caramelos más blandos. La textura final de un caramelo dependerá de la concentración de azúcar que a su vez depende del punto de ebullición. ¿Para qué se usa la D(+)-sacarosa?
La D(+)-sacarosa, o simplemente sacarosa, es el azúcar común. La D(+)-sacarosa, aparte de ser el edulcorante natural por excelencia de la alimentación humana, es el azúcar más utilizado por la industria farmacéutica para la elaboración de jarabes, comprimidos masticables, grageas, tabletas, etc. Los jarabes contienen sacarosa en una alta proporción, no sólo para lograr dulzura y viscosidad, sino para aumentar su estabilidad frente a microorganismos por la falta de disponibilidad de agua. Las altas concentraciones de azúcar hace que la elevada presión osmótica del jarabe impida el crecimiento bacteriano. La sacarosa es también un excipiente en vacunas. Como las vacunas son preparados biológicos, pueden ser inestables una vez creadas. Esta inestabilidad puede reducir la seguridad y la eficacia del producto biológico, las vacunas pueden ser sensibles al calor, la luz o los cambios en el entorno. La sacarosa mantiene la eficacia de las vacunas al impedir que las moléculas pierdan su forma en el proceso de fabricación, almacenamiento, distribución y, finalmente, cuando se administran a los pacientes. En la industria alimentaria, los azúcares en general, actúan como edulcorantes, potenciadores del sabor, antioxidantes y conservantes. Las reacciones químicas de los azúcares incluyen las reacciones de Maillard o la formación de compuestos pardos y caramelización. La sacarosa, en particular, actúa como estabilizador debido a sus propiedades humectantes naturales, se utiliza como un producto multifuncional ya que, no sólo endulza los alimentos, sino que también ayuda a que éstos, especialmente los productos de panadería y pastelería, se mantengan frescos y conserven su humedad; favorece la fermentación en el pan y otros productos que contienen levadura, mejora el sabor y la textura de alimentos en general y también como conservante y edulcorante en zumos, bebidas carbonatadas, refrescos y bebidas alcohólicas. Como cualquier otro soluto, la adición de azúcar a una mezcla modifica el punto de ebullición y congelación de la misma. Por ejemplo, en la fabricación de helados, los azúcares reducen el punto de congelación, evitando que el agua presente en el interior del helado se convierta en hielo, de esta forma se consigue una textura suave y apta para trabajarlo a pesar de las bajas temperaturas. En cambio, para la fabricación de caramelos, el aumento del punto de ebullición es el factor determinante de la textura del producto final. En general, a temperaturas más altas (mayor concentración de azúcar) quedan caramelos más duros y rígidos, mientras que las temperaturas más bajas producen caramelos más blandos. La textura final de un caramelo dependerá de la concentración de azúcar que a su vez depende del punto de ebullición. ¿Cuál es la función de la sacarosa como excipiente?
La sacarosa puede cumplir varias funciones en la industria farmacéutica, puede actuar como relleno o diluyente, por ejemplo si la cantidad de fármaco activo es demasiado pequeña para ser manipulada convenientemente; como aglutinante para mantener unidos los ingredientes de una formulación, por ejemplo en un comprimido; como material de recubrimiento, para aumentar la viscosidad o también como una de las funciones clave de la sacarosa: el sabor, enmascarando los sabores desagradables de las sustancias activas y haciendo que los productos farmacéuticos sean más apetecibles. Las altas concentraciones de azúcar en los jarabes hacen que la elevada presión osmótica del jarabe impida el crecimiento bacteriano. La sacarosa es también un excipiente en vacunas. La sacarosa mantiene la eficacia de las vacunas al impedir que las moléculas pierdan su forma en el proceso de fabricación, almacenamiento, distribución y, finalmente, cuando se administran a los pacientes. ¿Por qué a la sacarosa se le llama D(+)-sacarosa?
La sacarosa es ópticamente activa. La actividad óptica es la propiedad de una sustancia para hacer girar el plano de luz polarizada. La sacarosa hace rotar el plano de polarización en el sentido de las agujas del reloj (sentido horario), por lo que se le denomina azúcar dextrorrotatorio o déxtrógiro, es un isómero óptico (+). La nomenclatura D-L proporciona una abreviatura rápida para designar los enantiómeros. Estos compuestos poseen dos formas estereoisómeras y se designan con las letras D- y L-, delante del nombre del compuesto, pero no se debe confundir con la nomenclatura relativa a la clasificación de los enantiómeros en formas dextrógira (+) y levógira (-), la cual hace referencia a la actividad óptica. Los símbolos R y S se emplean actualmente para indicar la configuración, es decir el ordenamiento de átomos o grupos de átomos en el espacio, pudiendo en algunos casos emplearse otros términos como D y L. ¿Qué significa que un azúcar es reductor?
Un azúcar reductor es cualquier azúcar capaz de actuar como agente reductor. En solución alcalina, un azúcar reductor puede formar algún aldehído o cetona, lo que le permite actuar como agente reductor, por ejemplo en el reactivo de Benedict. En dicha reacción, el azúcar se convierte en un ácido carboxílico. Todos los monosacáridos son azúcares reductores, junto con algunos disacáridos, algunos oligosacáridos y algunos polisacáridos. Los monosacáridos pueden dividirse en dos grupos: las aldosas, que tienen un grupo aldehído, y las cetosas, que tienen un grupo cetona. Las cetosas deben tautomerizarse primero en aldosas antes de poder actuar como azúcares reductores. Los monosacáridos comunes de la dieta, la galactosa, la glucosa y la fructosa, son todos azúcares reductores. Los disacáridos se forman a partir de dos monosacáridos y pueden clasificarse como reductores o no reductores. Los disacáridos no reductores, como la sacarosa y la trehalosa, tienen enlaces glucosídicos entre sus carbonos anoméricos y, por lo tanto, no pueden convertirse en una forma de cadena abierta con un grupo aldehído; están cerrados enforma cíclica. Los disacáridos reductores, como la lactosa y la maltosa, sólo tienen uno de sus dos carbonos anoméricos implicados en el enlace glucosídico, mientras que el otro está libre y puede convertirse en una forma de cadena abierta con un grupo aldehído. El grupo funcional aldehído permite que el azúcar actúe como agente reductor, por ejemplo, en la prueba de Tollens o en la prueba de Benedict. Las formas hemiacetales cíclicas de las aldosas pueden abrirse para revelar un aldehído, y ciertas cetosas pueden sufrir tautomerización para convertirse en aldosas. Sin embargo, los acetales, incluidos los que se encuentran en los enlaces de polisacáridos, no pueden convertirse fácilmente en aldehídos libres. Los azúcares reductores reaccionan con los aminoácidos en la reacción de Maillard, una serie de reacciones que se producen al cocinar los alimentos a altas temperaturas y que es importante para determinar el sabor de los alimentos. Además, los niveles de azúcares reductores en el vino, el zumo y la caña de azúcar son indicativos de la calidad de estos productos alimenticios. ¿Cuál es el punto de fusión de la sacarosa?
Ninguno. La sacarosa se descompone a 186 °C. No se funde, pero cuando alcanza la temperatura de descomposición, la sacarosa se descompone en fructosa y glucosa. Al calentar la sacarosa se produce una proceso térmico complejo que implica tanto la fusión como la descomposición. Dependiendo de la velocidad a la que se caliente, se observarán cosas diferentes. Básicamente, la sacarosa comenzará a descomponerse cuando empiece a fundirse. Si hay algo de agua presente durante el proceso de calentamiento, se producirá una reacción conocida como inversión de la sacarosa y ésta se descompondrá en sus componentes, una molécula de glucosa y otra de fructosa. Sin embargo, si la sacarosa seca se calienta hasta su punto de fusión o descomposición, ocurren cosas más complejas. Inicialmente se detectan cantidades significativas de glucosa. El calentamiento continuado conduce a la "caramelización". La caramelización es un proceso de condensación en el que se elimina el agua de la sacarosa; a la pérdida inicial de agua le siguen la isomerización y la polimerización. Durante la caramelización, se cree que se forman varios miles de compuestos diferentes. Todavía se están realizando estudios para intentar identificarlos todos. Cuando esta mezcla compleja se enfría, deja de ser sacarosa. ¿Cuál es la solubilidad de la sacarosa?
La solubilidad de la sacarosa en agua es de 2039 g/L a 20 °C. ¿A qué se refiere la expresión azúcar invertido?
El azúcar invertido es un jarabe compuesto por glucosa y fructosa (monosacáridos) que se obtiene al hidrolizar la sacarosa (disacárido). La hidrólisis de la sacarosa genera una mezcla equimolar de fructosa y glucosa, conocida comercialmente como azúcar invertido, denominado así debido al cambio rotacional que modifica sus propiedades ópticas; de una rotación positiva o dextrógira a una rotación negativa o levógira. La sacarosa es dextrógira, con una rotación específica de +66,5°; al escindirse en glucosa (o dextrosa) que es dextrógira, con una rotación específica de [α] D = +52,7° y en fructosa (levulosa) fuertemente levógira, con una rotación específica de [α] D = -92°, la mezcla resultante es levógira, es decir, se ha invertido el sentido de rotación del plano de vibración de la luz respecto de la sacarosa original, y de ahí la denominación de azúcar invertido. La inversión de la sacarosa puede lograrse mediante hidrólisis ácida, o enzimática (utilizando invertasa). El azúcar invertido puede denominarse también: jarabe invertido, jarabe de azúcar invertido, jarabe simple, jarabe de azúcar, jarabe USP, sacarosa invertida, agua de azúcar o jarabe de barra. El jarabe de azúcar invertido es un 30% más dulce que la sacarosa y más fácil de incorporar a preparados alimentarios y farmacéuticos, ya que no presenta los problemas de cristalización de su precursor (la sacarosa), que cristaliza en soluciones muy concentradas. ¿Cuál es la rotación específica de la D(+)-sacarosa?
La rotación específica de la D-(+)-sacarosa α 20/D c=26 (en H2O) es +66,5°. En general, la rotación decrece linealmente con el aumento de la temperatura; sin embargo, la diferencia entre la rotación observada a 20 y 25 °C es generalmente despreciable. Normalmente en las farmacopeas las mediciones se realizan a 25 °C, empleando la linea D del sodio a la longitud de onda 589 nm. La rotación específica así determinada se expresa como α 25/D. ¿Cómo se mide la rotación específica de la sacarosa?
La rotación específica ([α]) es una propiedad de un compuesto químico quiral. Se define como el cambio de orientación de la luz monocromática polarizada en el plano, por unidad de producto distancia-concentración, cuando la luz atraviesa una muestra de un compuesto en solución. Los compuestos que rotan el plano de polarización de un haz de luz plana polarizada en el sentido de las agujas del reloj se dicen dextrógiros, y se corresponden con valores positivos de rotación específica, mientras que los compuestos que rotan el plano de polarización de la luz plana polarizada en sentido contrario a las agujas del reloj se dicen levógiros, y se corresponden con valores negativos. Si un compuesto es capaz de rotar el plano de polarización de la luz plana polarizada, se dice que es "ópticamente activo". La polarimetría es una técnica para distinguir entre sí, isómeros ópticamente activos, a partir de la medición de la rotación óptica de una sustancia; también es un criterio importante de identidad y pureza, pudiendo emplearse con fines cuantitativos. ¿Cuál es el número CAS de la sacarosa?
El número CAS de la sacarosa es 57-50-1. ¿A qué sustancia corresponde el número CAS 57-50-1?
El número CAS 57-50-1 corresponde a la D(+)-sacarosa. Se conoce comúnmente como azúcar, sacarosa o sucrosa, o por las siguientes denominaciones químicas: beta-D-fructofuranosil-alfa-D-glucopiranósido (nombre IUPAC), alfa-D-glucopiranosil-beta-D-fructofuranósido, α-D-glucopiranosil-(1→2)-β-D-fructofuranósido; β-D-fructofuranosil-(2→1)-α-D-glucopiranósido; β-(2S,3S,4S,5R)-fructofuranosil-α-(1R,2R,3S,4S,5R)-glucopiranósido; α-(1R,2R,3S,4S,5R)-glucopiranosil-β-(2S,3S,4S,5R)-fructofuranósido; ((2R,3R,4S,5S,6R)-2-[(2S,3S,4S,5R)-3,4-dihidroxi-2,5-bis(hidroximetil)oxapent-2-il]oxi-6-(hidroximetil)oxahexano-3,4,5-triol) ¿Qué son los grados Brix?
La medición de grados Brix es una aplicación muy conocida en la industria de alimentos y bebidas, entre otras. En sentido estricto, la medición de grados Brix constituye la determinación del contenido de sacarosa pura en el agua: 1 grado Brix (°Bx) = 1 g de sacarosa / en 100 g de solución En el caso de las frutas y verduras, este valor nos indica la cantidad de azúcar (sacarosa) presente, algo que influye determinantemente en su sabor. Medir la cantidad de azúcar en la fruta fresca es esencial para conocer su estado de madurez y el momento óptimo de su cosecha, según el tipo de producto y su variedad concreta. Existen normativas nacionales e internacionales de calidad que establecen unos grados Brix mínimos para la comercialización adecuada de cada producto." ¿Cómo se miden los grados Brix?
Para medir los grados Brix se pueden emplear diferentes instrumentos, aunque el más común es el refractómetro. Un refractómetro determina los grados Brix midiendo la refracción de la luz que pasa a través de una muestra de líquido. Los líquidos que contienen azúcares y/u otros sólidos disueltos son más densos que el agua y provocan una mayor refracción al pasar la luz. El instrumento compara esto con la refracción de la luz a través del agua y proporciona un valor Brix. El índice de refracción no sólo depende de la longitud de onda utilizada para medir, sino también de la temperatura de la solución que se está midiendo. Existe una relación directa entre el índice de refracción y el valor Brix. El índice de refracción medido se convierte directamente en contenido de sólidos en peso (°Brix). La escala Brix es una escala popular derivada del índice de refracción de una solución a 20 °C. ¿Dónde comprar sacarosa?
Puede comprar sacarosa en ITW Reagents a través de su red mundial de distribuidores, o a través de la tienda online si es un cliente registrado de ITW Reagents. Si desea adquirir sacarosa para procesos de producción, consulte a nuestros distribuidores. Siga este enlace para encontrar un distribuidor en su país https://itwreagents.com/rest-of-world/es/distribuidores-rw.