Packungsgrößen (8)
| Code | Packungsgröße | Einzelpreis | Boxpreis pro Stück | |
|---|---|---|---|---|
| Produktnr. & Packungsgröße | Einzelpreis | |||

|
Code
221881.1611
|
Packungsgröße
1000 ml
|
Einzelpreis
Stück
93,10€
|
Boxpreis pro Stück
79,14€x 6 Stück
|

|
Code
221881.1612
|
Packungsgröße
2,5 l
|
Einzelpreis
Stück
199,00€
|
Boxpreis pro Stück
169,15€x 4 Stück
|

|
Code
221881.16153
|
Packungsgröße
4 l
|
Einzelpreis
Stück
327,80€
|
Boxpreis pro Stück
278,63€x 4 Stück
|

|
Code
221881.0314
|
Packungsgröße
5 l
|
Einzelpreis
Stück
376,60€
|
Boxpreis pro Stück
320,11€x 4 Stück
|

|
Code
221881.0515
|
Packungsgröße
10 l
|
Einzelpreis |
Boxpreis pro Stück
|

|
Code
221881.0537
|
Packungsgröße
30 l
|
Einzelpreis |
Boxpreis pro Stück
|

|
Code
221881.0519
|
Packungsgröße
200 l
|
Einzelpreis |
Boxpreis pro Stück
|

|
Code
221881.0574
|
Packungsgröße
1000 l
|
Einzelpreis |
Boxpreis pro Stück
|
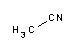
Technische Daten
- Schmelzpunkt:
- -48 °C
- Siedepunkt:
- 80 - 82 °C
- Dichte:
- 0,781 kg/l
- Brechungsindex:
- 20/D 1,344
- Physikalische Daten:
- flüssig
- Produktnummer:
- 221881
- Produktname:
- Acetonitril (Reag. Ph. Eur.) für HPLC gradient / UHPLC supergradient grade, ACS
- Qualität:
- für HPLC gradient / UHPLC supergradient grade, ACS
- Spezifikation:
- Minimum assay (GC): 99,9%
Identität: IR entspricht
Dichte 20/4: 0,779-0,783
Geeignet als Gradient nach ACS: entspricht
Bereich Destillation (>95% dest.): 80-82°C
Maximum der Verunreinigungen
APHA Farbe: 10
Azidität: 0,0005 meq/g
Alkalinität: 0,0001 meq/g
Nichtflüchtige Anteile: 0,0001 %
Basisliniendrift (210 nm): 10 mUA
Wasser (H2O): 0,015 %
Gradient 210 nm: 1 mUA
Gradient 254 nm: 0,5 mUA
Fluoreszenz 254 nm (Chinin): 1 ppb
Fluoreszenz 365 nm (Chinin): 0,5 ppb
UV-Spektrum (1cm Zelle; Ref.: Wasser):
Durchlässigkeit 190 (Cut off) nm: ≥30%
Durchlässigkeit 193 nm: ≥60%
Durchlässigkeit 195 nm: ≥80%
Durchlässigkeit 200 nm: ≥90%
Durchlässigkeit 230-400 nm: ≥98%
Daten von Interesse für die HPLC:
Rohrschneider Polarität: 5,8
Eluotropischer Wert e° (Al2O3): 0,65
Sol. H2O in solv. at 20°C: mischbar
Produkt durch Mikrofilter (0,2 μm) gefiltert und unter Stickstoffatmosphäre abgefüllt
Acetonitril entspricht für die Chromatographie und Acetonitril R1 nach Reag. Ph. Eur.
- Gefahrenpiktogramme
-
- UN:
- 1648
- Klasse/PG:
- 3/II
- ADR:
- 3/II
- IMDG:
- 3/II
- IATA:
- 3/II
- WGK:
- 2
- Lagerung:
- RT
- Signalwort:
- Gefahr
- GHS Symbole:
- GHS02
GHS07
- H-Sätze:
- H225
H332
H312
H302
H319
- P-Sätze:
- P210
P233
P240
P241
P242
P243
P261
P270
P271
P280
P301+P330+P331
P303+P361+P353
P304+P340
P305+P351+P338
P312
P322
P363
P370+P378
P501
P337+P313
- Mastername:
- Acetonitril
- Synonyme lang:
- Methylcyanid, Ethannitril, Essigsäurenitril, ACN
- EINECS:
- 200-835-2
- HS:
- 2926 90 70 90
- Index Nr.:
- 608-001-00-3









