En cultivo celular es importante trabajar en un espacio limpio ya que las contaminaciones son muy frustrantes para el científico y al final también muy costosas. ITW Reagents ofrece una variedad de productos para la prevención, detección y lucha contra la contaminación.
Micoplasma en Cultivo Celular
La contaminación de las líneas celulares con micoplasma es un problema generalizado y a menudo subestimado. Aunque los signos visibles como la turbidez o los cambios en el pH son raros, las infecciones por micoplasma pueden causar una serie de alteraciones celulares, que van desde una tasa de crecimiento desacelerada y propiedades inmunológicas alteradas hasta cambios metabólicos y morfológicos. Las consecuencias de la contaminación por micoplasma son graves, tanto en lo que se refiere a los métodos científicos, como a cualquier tipo de ensayo celular, como a los riesgos para la salud humana y animal.
En esta página usted aprenderá más sobre la detección de especies de micoplasma, el tratamiento de cultivos celulares contaminados y la prevención efectiva de nuevas infecciones. También proporcionamos una amplia base para una mejor comprensión de las razones y consecuencias de la contaminación por micoplasma.
Detección de especies de micoplasma

¿Cómo puedo identificar una contaminación por micoplasma?
El método más sensible para detectar el micoplasma es el método de cultivo directo en caldo y agar adecuados para obtener colonias visibles. Teóricamente, se puede detectar una sola UFC (unidad formadora de colonias) por volumen de muestra. Desafortunadamente este método es también el que más tiempo consume (hasta 28 días; debido al lento crecimiento de las especies de micoplasmas), y requiere personal experimentado que realice los experimentos bajo condiciones ambientales controladas. Incluso si el procedimiento difícil (para empezar con la composición compleja del medio que a menudo requiere ajustes no estándar para especies individuales hasta el análisis de los resultados) se lleva a cabo correctamente, el método no es 100% efectivo ya que algunas cepas exigentes pueden no crecer en cultivo puro. Por lo tanto, debería realizarse además un método de detección indirecta.
Las pruebas indirectas de micoplasma más sensibles se basan en la tinción de ADN fluorocromo (por ejemplo, utilizando DAPI, A1001) y PCR. Aunque el límite de detección de estos métodos sea inferior al del método de cultivo directo, son absolutamente suficientes para las pruebas de rutina. Comúnmente, los cultivos celulares contaminados por micoplasma muestran altas densidades de micoplasma (hasta 107 - 108 CFU/ml) que son adecuadas para los límites de detección de estos métodos. A diferencia de la alternativa PCR, el método tradicional de tinción por fluorescencia requiere más tiempo y experiencia. Además, la tinción fluorescente de unión de ADN es cancerosa y necesita ser manejada con cuidado. Por lo tanto, para los exámenes rutinarios de micoplasma, se recomienda el análisis por PCR. Este método es sensible (dependiendo del kit casi tan sensible como el método de cultivo directo), muy rápido (los resultados se obtienen en cuestión de horas) y detecta especies de micoplasmas cultivables y no cultivables. Además, al menos con los kits disponibles en el mercado, este método es muy fácil de realizar y no requiere una experiencia específica.
Los Kits de Ensayo PCR Mycoplasma PanReac AppliChem permiten la identificación de cultivos celulares contaminados con micoplasma - ¡rápido y efectivo! La técnica PCR permite la detección altamente sensible de especies de micoplasmas cultivables y no cultivables. Los resultados reproducibles se obtienen en cuestión de horas, lo que convierte a la PCR en el método de elección para las pruebas de rutina frecuentes.
| CÓD. PROD. | DESCRIPCIÓN | CARACTERÍSTICAS |
| A3744 | PCR Test Kit Micoplasma | Listo para usar (Taq Polimerasa incluida!); contiene un control positivo de ADN |
| A8994 | PCR Test Kit II Micoplasma | Máxima sensibilidad de < 10 CFU/ml; según Ph. Eur. (sección 2.6.7). Además de un control positivo de ADN (¡no infeccioso!), este kit proporciona un control interno de ADN para visualizar las posibles inhibiciones de la PCR. La Polimerasa ADN no está incluida, recomendamos Hotstart Taq Polimerasa, por ejemplo, SuperHot Taq Polimerasa ADN (A5231) |
PCR Test Kit Micoplasma: ¿Cómo funcionan?
El principio es simple: Un fragmento de ADN específico de micoplasma se amplifica exclusivamente por PCR, utilizando un set de primers específico. Sólo si el ADN de micoplasma está presente en la muestra, se obtiene un producto de PCR específico de micoplasma de tamaño definido (270 pb), detectable en un gel de agarosa o, en el caso del kit de ensayo qPCR, utilizando el canal de detección FAM. El set de primers se une selectivamente a la altamente conservada región codificadora 16S rRNA operón del genoma del micoplasma, sin detectar ningún otro ADN bacteriano o eucariotas. El rango de detección incluye los contaminantes más frecuentes M. fermentans, M. arginini, M. orale, M. hyorhinis, M. salivarium, M. hominis, pero también especies de micoplasma menos frecuentes, como M. pneumoniae, Acholeplasma laidlawii, M. synoviae, M. pulmonis, M. bovis - por nombrar sólo algunos.
Una nueva generación de kits de ensayo PCR Micoplasma
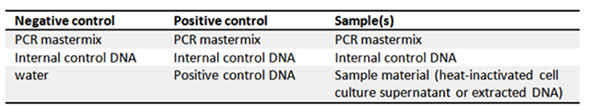
Además de un control positivo de ADN, el kit de nueva generación PCR Test Kit Micoplasma A8994 ofrece un control interno de ADN opcional como marcador de inhibición. Para ello, el control interno de ADN debe añadirse a la mezcla maestra para visualizar las ejecuciones incompletas o inhibidas de la PCR. Además, los kits contienen una mezcla liofilizada Primer/Nucleótidos, una solución tampón y agua de grado PCR. Para una evaluación óptima de los resultados, se recomienda incluir siempre un control negativo y uno positivo.
¿Qué voy a conseguir? ¿Cómo serán mis resultados?
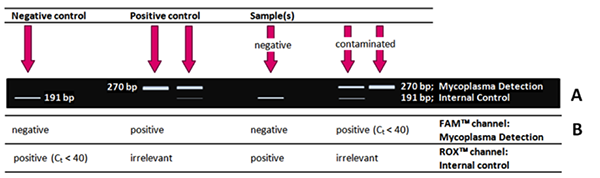
Si su PCR fue exitosa, normalmente obtendrá los siguientes resultados para control negativo, control positivo, muestra negativa y positiva (contaminada) después de la PCR estándar (Test Kit II, A8994) y evaluación mediante electroforesis en gel de agarosa.
Factores Clave
- Evite congelar y descongelar repetidamente. Después de la reconstitución, la Mezcla de Primer/Nucleótidos, el ADN de Control Positivo y el ADN de Control Interno se almacenarán a -20°C en alícuotas apropiadas. También es posible almacenar alícuotas de la mezcla maestra lista para usar en tubos PCR a -20°C.
- Asegúrese de no contaminar el ADN de Control Interno durante la reconstitución, al tomar alícuotas o al pipetear en general. Para garantizar la máxima sensibilidad en la detección de micoplasmas, hemos ajustado con precisión la concentración más baja posible del ADN de control interno participante, lo que lo hace muy susceptible a la degradación microbiana.
- Utilice un ADN polimerasa apropiada. La mezcla de reacción está optimizada para ADN polimerasas de Taq Hotstart; recomendamos SuperHot Taq DNA Polymerase (A5231).
- Use tubos estériles y libres de ADN. Precaución: No autoclave los tubos PCR si el autoclave también se utiliza para la esterilización de residuos (microbianos). Los autoclaves son una fuente de contaminación de ácidos nucleicos en los laboratorios y no son adecuados para destruir ácidos nucleicos. Durante el autoclave, las moléculas de ADN fragmentadas se liberan en grandes cantidades con el vapor, contaminando fácilmente los materiales y las superficies que entraron en contacto con ellas.
- Las muestras deberían derivarse del sobrenadante de cultivos que se encuentra en una confluencia del 90-100 %. Con títulos medios a 106 y un título máximo a 108, hay cantidades suficientes de ADN de micoplasma para garantizar una PCR sensible.
- Desactivar por calor el material de la muestra. El material de muestra derivado de cultivos celulares contiene DNasasas que pueden degradar el ADN del micoplasma incluso a bajas temperaturas. Por lo tanto, recomendamos la desactivación por calor (calentamiento directo del sobrenadante del cultivo celular o del material biológico de la muestra) inmediatamente después de la toma de muestras o de la extracción de ADN.
- Asegúrese de que su muestra no contenga ningún inhibidor de la PCR, como restos celulares, alcohol o tampón PBS. Las sustancias inhibidoras de la PCR también pueden acumularse en el medio de cultivos más antiguos (>100% de confluencia).
- En el caso de materiales de muestra críticos, como cultivos celulares antiguos, gránulos celulares, así como suero fetal de ternera y vacunas, se recomienda estrictamente la extracción de ADN antes de la prueba. Asegúrese de retirar de la preparación todo el alcohol que contenga tampón de lavado para evitar la coelución del alcohol y del material de la muestra.
Solución de problemas

No hay señal de control interno en el control positivo (o una muestra muy contaminada).
De hecho, esto no es un problema, pero es muy probable, ya que ambas reacciones de PCR están compitiendo! El ADN de control interno se aplica para demostrar la inhibición de la PCR en una muestra negativa de micoplasma. Si no hay una plantilla de ADN de micoplasma en la mezcla de reacción, el ADN de control interno se amplifica exclusivamente. En presencia de ADN de micoplasma, el ADN de control interno se diluye fuertemente, lo que resulta en una señal muy débil o incluso inexistente.

No hay señal de Control Interno en el Control Negativo (y en muestras aparentemente negativas).
Hay dos posibles razones para este resultado: En primer lugar, el ADN de control interno no se añadió a la mezcla maestra o, en segundo lugar, se ha contaminado con bacterias, por ejemplo, por una punta de pipeta no estéril. Dado que el ADN de Control Interno se caracteriza por una concentración muy baja - para garantizar la máxima sensibilidad posible en la detección de micoplasmas - es rápidamente degradado por las bacterias.

No hay señal en las muestras, ni en el ADN de micoplasma, ni en el ADN de control interno.
Inhibición de la PCR. Las razones pueden ser metabolitos liberados por las células que inhiben la polimerasa del ADN u otras sustancias que interfieren, como el alcohol o el fosfato, que contienen amortiguadores. Otra posibilidad es que el material de la muestra (¡el sobrenadante del cultivo celular!) pueda estar contaminado por restos celulares residuales. En todos estos casos, se requiere una extracción de ADN antes de la PCR.
Tratamiento de cultivos celulares contaminados
¿Cómo eliminar el micoplasma de un cultivo celular infectado?
La manera más fácil de eliminar el micoplasma es autoclavar las células contaminadas junto con cualquier botella de medio y solución utilizada con este cultivo relevante. No olvide la posterior limpieza y desinfección de superficies, campanas, incubadoras, pipetas, etc. - o mejor dicho, ¡todo el laboratorio! ¡Asegúrese de que las demás líneas celulares no estén infectadas también!
Dado que los esfuerzos y los costes son elevados, la limpieza de un cultivo contaminado mediante el tratamiento antimicoplasma sólo tiene sentido en el caso de cultivos muy valiosos o irremplazables, y si la fuente potencial de micoplasma es desterrada del laboratorio.
A pesar de las resistencias aseguradas, el tratamiento más fiable y eficaz de las contaminaciones por micoplasma es la adición de antibióticos adecuados, como quinolonas, tetraciclinas y macrólidos.Además de los agentes tradicionales que eliminan el micoplasma Myco-1 y 2 (tiamulina y minociclina) y Myco-3 (ciprofloxacina), ITW Reagents ofrece una solución para la eliminación eficaz y permanente de especies de micoplasma del cultivo celular: Myco-4 proporciona un amplio espectro de actividad (incluyendo cualquier tipo de micoplasma, acholeplasma, espiroplasma y entomoplasma) combinado con una citotoxicidad muy baja y un bajo riesgo de resistencia debido a un modo de acción biofísico inicial.
| CÓD. PROD. | DESCRIPCIÓN | CARACTERÍSTICAS |
| A5240 | Myco-3 | Tratamiento monofásico con Ciprofloxacino |
| A8366 | Myco-4 | Tratamiento en 2 etapas con un reactivo biofísico específico de micoplasma seguido de una combinación adecuada de antibióticos |

Eliminación de Micoplasma por Myco-4: ¿Cómo funciona?
Myco-4 se utiliza para la eliminación de micoplasma, acholeplasma, espiroplasma y entomoplasma en todo tipo de cultivos celulares.
Myco-4 es una combinación altamente eficiente de antibióticos estándar y un agente biológico. El agente biológico se integra en la membrana del micoplasma y compromete su integridad. En combinación con antibióticos estándar, la dosis efectiva de ambos, agente biológico y antibióticos, puede reducirse al mínimo para reducir al mínimo la citotoxicidad, causando aún así una eliminación altamente fiable y definitiva del micoplasma. Además, las propiedades biofísicas de Myco-4 hacen muy improbable el desarrollo de cepas resistentes.
Una aplicación incluye 4 viales, un Tratamiento Inicial (tapa roja) y tres soluciones de Tratamiento Principal (tapa amarilla). El Tratamiento Inicial mata la mayoría de las partículas de micoplasma sin dañar las células. El tratamiento principal mata las partículas restantes, lo que conduce a una erradicación permanente con tasas de eficiencia de hasta el 100%. Cada componente es una solución estéril y lista para usar.
Las células contaminadas se incuban una vez con la solución de Tratamiento Inicial (durante el período de tiempo común de un paso normal, o al menos 30 minutos) y tres veces con el reactivo Myco-4 Tratamiento Principal (cada vez durante el período de tiempo de un paso).
La condición previa para una eliminación exitosa del micoplasma es un número limitado de células individuales y una concentración reducida de suero durante la incubación con la solución de Tratamiento Inicial.
Factores Clave
- Utilice un máximo de 105 células para un tratamiento que mantenga baja la carga de micoplasma y evite interacciones con la superficie de la célula.
- Asegúrese de que el Tratamiento Inicial Myco-4 ya esté presente en el medio de cultivo antes de añadir células. Añadir las células directamente a la mezcla de eliminación para evitar la evaporación (¡insertar la punta de la pipeta directamente en la mezcla!).
- Dado que el Tratamiento Inicial Myco-4 funciona por medios biofísicos a través de la asociación con la membrana del micoplasma, el reactivo necesita contacto directo con la partícula del micoplasma para ser efectivo. No trate los grupos de células. Sugerimos usar Tripsina (A3964) para separar las células unas de otras y alisar las superficies celulares.
- Asegurar el tratamiento de células individuales (verificar bajo el microscopio). Si es necesario, aumente la duración del tratamiento con Tripsina o separe las células unas de otras pipeteando hacia arriba y hacia abajo.
- La eliminación del micoplasma en soluciones altamente concentradas de proteínas o lípidos no es posible. La actividad micoplasmática del Tratamiento Inicial Myco-4 se ve afectada por los lípidos y las proteínas de la mezcla de reacción, por ejemplo, los componentes del suero de ternera fetal suplementado. Estos ingredientes se unen al Tratamiento Inicial Myco-4 y evitan que se unan a la membrana del micoplasma. Nuestro protocolo es aplicable para un máximo de 5% v/v de suero fetal de ternera. Para el Tratamiento Principal Myco-4 ya no es necesaria la reducción de suero al 5%; la concentración de FCS puede ajustarse al contenido habitual.
- Myco-4 es adecuado tanto para líneas celulares adherentes como para líneas celulares de suspensión. Las líneas celulares que ya fueron tratadas con éxito incluyen Vero, BHK21, GBK, ML, Hep2, 293, CRFK, Jurkat, Molt 4, MT-4. Los virus se tratarán en combinación con sus células huéspedes. Las células que albergan Clamidia u otras bacterias como sistemas huéspedes no pueden ser tratadas. La porción de antibióticos del producto podría afectar a los microorganismos integrados.
- Los antibióticos, especialmente si son necesarios para la selección, no interfieren con el procedimiento de eliminación. En casos raros, la citotoxicidad puede verse incrementada por interacciones impredecibles de los reactivos.
- Myco-4 no penetra la membrana celular. Por lo tanto, no puede eliminar la contaminación intracelular. Sin embargo, el micoplasma es un contaminante extracelular. Mycoplasma penetrans es la única especie descrita que persiste intracelular. Hasta ahora, M. penetrans no ha sido reportado como contaminante en el cultivo celular.
Prevención de Micoplasma

¿Cómo puedo evitar contaminaciones?
Probablemente, nunca habrá un momento en el tiempo en que las contaminaciones por micoplasma sean completamente desterradas de nuestros laboratorios, siempre y cuando los humanos estén trabajando allí. Pero llevar a cabo algunos principios generales seguramente minimizará el riesgo de contaminación y evitará situaciones costosas o embarazosas.
- Siga estrictamente las técnicas y prácticas asépticas, incluyendo no hablar innecesariamente, no pipetear la boca, no verter medios, lavarse las manos y desinfectarse regularmente. No utilice el flujo laminar para el almacenamiento de soluciones y equipos. Trabaje sólo con UNA línea celular a la vez y utilice materiales separados para cada línea celular para evitar contaminaciones cruzadas. Asegúrese de que todos los medios, soluciones y materiales estén debidamente esterilizados - ¡lo mismo se aplica a cualquier tipo de residuo que se produzca, por supuesto!
- Limpie y desinfecte con frecuencia las superficies, los flujos laminares, las incubadoras, los baños de agua y todos los demás equipos, antes y después del procedimiento de trabajo. Asegúrese de que el laboratorio se limpie regularmente y de que sólo las personas autorizadas tengan acceso al área de trabajo.
- Use los antibióticos de manera responsable. Para el trabajo rutinario de cultivo se deben emplear medios libres de antibióticos. El uso general de antibióticos para enmascarar los bajos niveles de higiene, la falta de buenas técnicas asépticas o las instalaciones inadecuadas de cultivo celular no es un remedio. Por el contrario, el uso no responsable de antibióticos empeorará aún más la situación. Especialmente las tasas de contaminación por micoplasma son mucho más altas en líneas celulares cultivadas en medios que contienen antibióticos que en cultivos libres de antibióticos. Los antibióticos más comunes usados en el cultivo celular no actúan sobre el micoplasma! Además de los betalactámicos generalmente ineficaces, se determinaron niveles muy altos de resistencia de micoplasma contra estreptomicina, kanamicina, gentamicina y neomicina.
De todos modos, existen aplicaciones útiles para los antibióticos en el cultivo celular, por ejemplo, durante las dos primeras semanas del cultivo primario. Para no crear nuevas resistencias debido a la inactivación del antibiótico, el medio que contiene el antibiótico debe ser refrescado frecuentemente. Como una excelente alternativa a los antibióticos de cultivo celular clásicos como PenStrep, ITW Reagents proporciona un producto para prevenir el crecimiento microbiano en cultivos celulares: CellCultureGuard A8906. Esta combinación de antibióticos seleccionados (uno de ellos es una fluoroquinolona) ofrece una amplia gama de actividad antimicrobiana, por lo que es nuestro reactivo de cultivo celular de primera elección: CellCultureGuard es activo contra bacterias extra e intracelulares, micoplasmas, protozoos y hongos (levaduras). Además, es altamente compatible con los marcadores de resistencia y tiene un bajo riesgo de desarrollo de resistencia. - Aislar los cultivos celulares entrantes (utilizar una incubadora separada o al menos frascos sellados, así como medios de cultivo y materiales separados) hasta que se demuestre que los resultados de la prueba de micoplasma son negativos.
- Compruebe frecuentemente si hay contaminación, independientemente de si el cultivo celular contiene o no antibióticos. Las pruebas de rutina para detectar la presencia de especies de micoplasma son absolutamente necesarias para el científico responsable. Sólo mediante la identificación y el tratamiento o la eliminación de la línea celular infectada se elimina el riesgo de nuevas contaminaciones (cruzadas) y los experimentos arrojan resultados estables y fiables.
ITW Reagents ofrece una serie de productos que previenen la contaminación microbiana - en campanas, incubadoras, baños de agua y cultivos celulares.
| CÓD. PROD. | DESCRIPCIÓN | CARACTERÍSTICAS |
| A5230 | Incubator-Clean™ | Desinfectante no tóxico y biodegradable para incubadoras y bancos estériles; previene la contaminación y el crecimiento de hongos, bacterias (incluyendo micoplasma) y virus (incluyendo VIH y hepatitis B). Totalmente compatible con las superficies de trabajo más comunes (¡no corrosivo!) |
| A5219 | Incuwater-Clean™ | Desinfectante no tóxico, no volátil y extremadamente efectivo para baños de agua de incubadoras de CO2. |
| A9390 | Aquabator-Clean (100X) | Desinfectante para la prevención de la proliferación microbiana en baños de agua comunes. |
| A8906 | CellCultureGuard | Combinación de antibióticos especialmente seleccionados para prevenir el crecimiento microbiano (bacterias extracelulares e intracelulares, micoplasmas, protozoos y hongos) en cultivos celulares; proporciona una alta compatibilidad con los marcadores de resistencia y un bajo riesgo de desarrollo de resistencia. |
La historia del Micoplasma: ¿Qué es importante saber?
En 1956 (Robinson et al. 1956), la presencia potencial de micoplasma en laboratorios de cultivo celular es un desafío para los científicos. Los micoplasmas parasitarios representan un grave problema para todos los campos relacionados con la línea celular, tanto en la investigación como en las instalaciones industriales para el desarrollo o la fabricación de productos biológicos y farmacéuticos derivados de las células, incluidas las vacunas, los anticuerpos monoclonales, los medicamentos y los productos para la terapia génica y celular. Aún así, no hay una reducción perceptible de las tasas de infección de los cultivos celulares (Ryan 2008), a pesar de que los riesgos y las consecuencias causadas por las infecciones por micoplasma se conocen desde hace décadas, y las estrategias para su prevención, detección y eliminación están bien establecidas. ¿Por qué tantas líneas celulares, aunque comúnmente bien fomentadas por sus cultivadores de células, todavía no están suficientemente protegidas contra el invasor sin pared celular? ¿Es esto una causa de descuido, o más bien una falta de conocimiento? Lamentablemente, no podemos proporcionar datos sobre esta cuestión, pero sí muchos hechos que demuestran la importancia del tema impopular.
¿Cómo entran los micoplasmas comúnmente en nuestros laboratorios y cultivos?
Los micoplasmas son omnipresentes; su amplia gama de huéspedes incluye humanos y otros mamíferos, aves, reptiles, peces, insectos y plantas (Razin et al. 1998). Sin embargo, en los laboratorios de cultivo celular, el 95% de todas las infecciones continuas de la línea celular son causadas por sólo seis especies originarias de bovinos (M. arginini y Acholeplasma laidlawii), porcinos (M. hyorhinis) y humanos (M. orale, M. fermentans, M. hominis) (Drexler y Uphoff, 2002). La principal fuente de contaminación por micoplasma en la actualidad son otros cultivos celulares infectados por micoplasma utilizados en el mismo laboratorio (Rottem & Barile 1993, Drexler et al. 2002; Drexler & Uphoff 2002). La infección puede ser transmitida por aerosoles, partículas y técnicas inadecuadas de cultivo celular, directa o indirectamente a través de medios, soluciones y equipos de laboratorio contaminados por el uso previo en el procesamiento de células infectadas por micoplasma. Como resultado, el 15-35% de todas las líneas celulares continuas son positivas para micoplasma, pero sólo el 1% de los cultivos celulares primarios (Drexler & Uphoff, 2002). La segunda fuente principal es el personal de laboratorio, explicando el hecho de que las especies de micoplasma de origen humano son los contaminantes más comunes (responsables del 40-80% de las infecciones) con M. orale, comúnmente colonizando la cavidad oral, representando la especie primaria aislada de cultivos celulares contaminados.
Las especies de micoplasma de bovinos o porcinos pueden rastrearse hasta los sueros contaminados y otros productos de origen animal, por ejemplo, la presencia prevalente de A. laidlawii y M. arginini implica que el suero bovino fetal o recién nacido es la fuente primaria de infección.
En la actualidad, los sueros y los medios rara vez son la fuente de contaminación por micoplasma (Lincoln & Lundin 1990; Armstrong et al. 2009), siempre y cuando se compren a fabricantes de renombre que esterilizan sus productos mediante varios pasos de filtración utilizando un filtro de membrana de poro de 0,1 µm y que con frecuencia controlan la esterilidad.
¿Qué hace que las especies de micoplasma sean peores que otras bacterias contaminantes y por qué es necesario eliminarlas de los cultivos celulares?
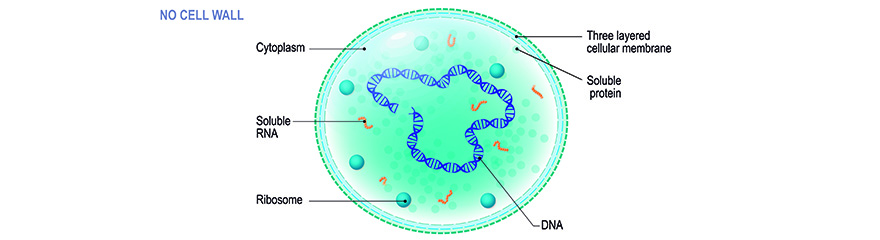
A diferencia de las bacterias "comunes", estos pequeños procariotas no poseen una pared celular. Junto con otras bacterias que carecen de pared celular - especies de ureaplasma, acholeplasma, anaeroplasma, espiroplasma - forman la clase de moléculas. Sin embargo, los términos "micoplasma" o anteriormente "organismos similares a la pleuroneumonía (PPLO)" y "mollicutos" se utilizan a menudo como sinónimos. Debido a la ausencia de una pared celular, los micoplasmas no se ven afectados por los antibióticos que interfieren con la formación de peptidoglicanos, es decir, los antibióticos beta-lactámicos. Estos incluyen derivados de la penicilina, cefalosporinas y carbapenemas. Además, tienen una forma muy flexible que, además de su pequeño tamaño (que oscila entre 0,1 y 0,8 µm de diámetro, dependiendo de la bibliografía), dificulta su filtrado de las soluciones. Las especies de micoplasma penetran fácilmente en la membrana de los filtros de 0,2 µm comúnmente utilizados para la esterilización de medios, sueros y otros reactivos esterilizables en autoclave. La dependencia general de Mycoplasma de medios enriquecidos complejos (incluyendo los nutrientes de las células huéspedes) y las condiciones ambientales definidas - ambos perfectamente realizados en el cultivo celular - y sus tasas de crecimiento muy lentas complican la identificación de las células infectadas por los métodos de cultivo microbiológicos comunes. Su pequeño tamaño y la falta de pared celular les permite alcanzar altas densidades en cultivos celulares; a menudo sin ser detectables por turbidez, citopatogenicidad o incluso examen microscópico. Sin embargo, las consecuencias de la contaminación por micoplasma no deben subestimarse, ni en lo que se refiere a la investigación (¡y a la carrera del investigador!), ni en términos de graves riesgos para la salud humana y animal.
Por favor, tenga en cuenta que la familia de los micoplasmas está compuesta por una serie de organismos patógenos
Al crecer de manera encubierta y sin ser perturbado dentro de un cultivo celular, el micoplasma puede fácilmente tomar el control de reactivos, equipos y otras líneas celulares en cuestión de semanas (McGarrity 1976). Tenga en cuenta que la falta de efectos visibles proporciona una falsa sensación de seguridad: Aunque a menudo se comportan discretamente a primera vista, los organismos fastidiosos son capaces de influir en casi todas las funciones celulares, desde una tasa de crecimiento desacelerada hasta cambios metabólicos (incluyendo proteínas, ARN, síntesis de ADN) y morfológicos. Todos estos efectos se basan principalmente en la competencia por nutrientes esenciales (nucleósidos, nucleótidos, nucleobases, arginina y otros aminoácidos, ácidos grasos, azúcares, etc.) y la liberación de metabolitos tóxicos, citolíticos o ácidos. Mediante la regulación al alza y a la baja de citoquinas y factores de crecimiento, genes de respuesta al estrés, proteínas de transporte, receptores, canales iónicos, oxidasas, supresores tumorales y oncogenes, los micoplasmas alteran significativamente los perfiles de expresión génica de las células cultivadas (Miller et al. 2003). Por lo tanto, hacen cuestionable cualquier experimento realizado con células infectadas! Además, se sabe que causan aberraciones cromosómicas in vitro, siendo los resultados más frecuentes la rotura cromosómica, los eventos de translocación y la reducción o aumento del número de cromosomas. La propagación del virus también puede verse influenciada en ambas direcciones, tanto positivamente (al inhibir la inducción y actividad del interferón) como negativamente (al competir por los nutrientes esenciales). Aunque hay un gran número de efectos potenciales descritos en la literatura, es impredecible qué efecto ocurrirá. Los posibles efectos dependen de la especie y cepa del micoplasma, del tipo de célula infectada y, por supuesto, de las condiciones ambientales (Rottem & Barile 1993).

Por último, además de las preocupaciones en materia de bioseguridad, las consecuencias de la contaminación por micoplasma en el trabajo de laboratorio son la pérdida de tiempo, esfuerzos, dinero (en relación con las células, los medios de comunicación, los materiales, pero también valiosos biofármacos si los cultivos se utilizaron para la producción de vacunas, anticuerpos o medicamentos) y buena reputación. La investigación basada en líneas celulares contaminadas con micoplasma producirá resultados inexactos o erróneos que producirán publicaciones engañosas. Considere la vergüenza personal y tal vez la pérdida de buena reputación si se comprueba que los resultados publicados son defectuosos debido a un problema de contaminación. ¿Y qué tan incómodo será que un colega te informe de que la línea celular que le proporcionaste está contaminada? Todos estos factores deben ser reconsiderados cuando se calcula para tomar el riesgo de infecciones encubiertas por micoplasma NO probando cultivos celulares y NO previniéndolos activamente con buenas prácticas de laboratorio.
En resumen, un cultivo celular libre de micoplasma es una PRECONDICIÓN para la seguridad y pureza de los productos derivados de las células y resultados fiables en los experimentos científicos.
El buen mensaje: es posible minimizar el riesgo de contaminación general por micoplasma y excluir brotes graves.
El "problema del micoplasma" es conocido desde hace décadas - ¿Por qué sigue existiendo?
Hay dos razones principales por las que las contaminaciones por micoplasma no son desterradas de los laboratorios de cultivo celular todavía: En primer lugar, la mitad de los investigadores todavía no realizan pruebas de micoplasma en sus cultivos celulares (Ryan 2008) y, en segundo lugar, hay una tendencia a confiar en los antibióticos en vez de en las buenas prácticas asépticas.
Aunque los expertos en cultivos celulares están de acuerdo en que el uso general de antibióticos puede aumentar la gravedad de los problemas de contaminación, el uso rutinario de antibióticos en los laboratorios de cultivos celulares sigue siendo frecuente. En particular, las tasas de contaminación por micoplasma son mucho más altas en las líneas celulares cultivadas en medios que contienen antibióticos que en los cultivos libres de antibióticos (Barile 1973). Si los microorganismos, bacterias u hongos se introducen accidentalmente en un medio de cultivo libre de antibióticos, se replicarán no inhibidos, lo que pronto dará lugar a indicadores visibles de contaminación: turbidez, estructuras filamentosas, cambios de color debido a la alteración del pH. En contraste, la presencia de antibióticos prevendrá el crecimiento microbiano - tal vez. Desafortunadamente no existe una garantía absoluta de que los antibióticos añadidos actúen contra los microorganismos introducidos (probablemente una mezcla de diferentes especies), y tarde o temprano el usuario se enfrentará a algún tipo de fenómeno de resistencia. Si el germen introducido es totalmente resistente al antibiótico, es de esperar que rápidamente sobrecrezca el cultivo y se haga visible en un corto período de tiempo. Si el microorganismo introducido sólo muestra una resistencia parcial, la situación es peor. Debido al nivel estático latente de las contaminaciones parcialmente resistentes, no se debe subestimar el riesgo de contaminaciones cruzadas y el uso del cultivo afectado en experimentos o bioproducción. Este peor caso es muy probable si el invasor pertenece a la especie de micoplasma (por ejemplo, introducido en el cultivo a través de gotitas de aerosol de la boca del cultivador de células), ya que la mayoría de los antibióticos comunes utilizados en el cultivo celular no actúan sobre el micoplasma. Además de que los betalactámicos son ineficaces, se determinaron altos niveles de resistencia de micoplasma contra la estreptomicina (88%), kanamicina (73%), gentamicina (80%) y neomicina (86%) (Lundin & Lincoln 1994).
Aparte de la observación de Barile de que las tasas de contaminación por micoplasma han aumentado considerablemente, los cambios morfológicos y funcionales son otras desventajas que hay que tener en cuenta (Kuhlmann 1996) cuando se utilizan antibióticos de forma rutinaria. De todos modos, existen aplicaciones útiles para los antibióticos en el cultivo celular, por ejemplo, durante las dos primeras semanas del cultivo primario. Para no crear nuevas resistencias debido a la inactivación del antibiótico, el medio que contiene el antibiótico debe ser refrescado frecuentemente.
Referencias
- Armstrong SE, Mariano JA and Lundin DJ (2010) The Scope of Mycoplasma Contamination within the Biopharmaceutical Industry. Biologicals 38: 211-213.
- Barile MF, Hopps HE, Grabowski MW, Riggs DB and Del Giudice RA (1973) The Identification and Sources of Mycoplasmas Isolated from Contaminated Cell Cultures. Ann. NY Acad. Sci. 225:251-264
- Drexler HG and Uphoff CC (2002) Mycoplasma Contamination of Cell Cultures: Incidence, Sources, Effects, Detection, Elimination, Prevention. Cytotechnology 39:75-90.
- Drexler HG, Uphoff CC, DirksWG and MacLeod RAF (2002) Mixups and mycoplasma: The enemies within. Leukemia Res 26:329–333.
- Kuhlmann I (1996) The Prophylactic Use of Antibiotics in Cell Culture. Cytotechnology 19: 95-105.
- Lincoln CK and Lundin DJ (1990) Mycoplasma Detection and Control. United States Federation for Culture Collection Newsletter 20 (4):1-3.
- Lundin DJ and Lincoln CK (1994) Mycoplasmal Contamination of Cell Cultures within the Clinical Diagnostic Laboratory. Amer. Clin. Lab. April (4):6
- McGarrity GJ (1976) Spread and Control of Mycoplasmal Infection of Cell Cultures. In Vitro 12:643-647.
- Miller CJ, Kassem HS, Pepper SD, Hey Y, Ward TH, Margison GP (2003) Mycoplasma infection significantly alters microarray gene expression profiles. BioTechniques 35:812-814.
- Razin S, Yogev D and Naot Y (1998) Molecular biology and pathogenicity of mycoplasmas. Microbiol Mol Biol Rev 62, 1094-1156.
- Robinson LB, Wichelhausen RH and Roizman B (1956) Contamination of Human Cell Cultures by Pleuropneumonia-like Organisms. Science 124:1147-1148.
- Rottem S and Barile MF (1993) Beware of Mycoplasmas. Trends in Biotechnology 11:143-150.
- Ryan JA (2008) Understanding and Managing Cell Culture Contamination. Corning, Inc. Technical Bulletin
