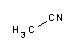Comments
Acetonitril, oft mit MeCN (Methylcyanid) abgekürzt, ist eine chemische Verbindung mit der Formel CH3CN und der Struktur H3C-C≡N. Diese farblose Flüssigkeit ist das einfachste organische Nitril (Blausäure ist ein einfacheres Nitril, aber das Cyanid-Anion wird nicht als organisch eingestuft). Sie wird hauptsächlich als Nebenprodukt bei der Herstellung von Acrylnitril gewonnen. Es wird als polares aprotisches Lösungsmittel in der organischen Synthese und bei der Reinigung von Butadien verwendet. Das N≡C-C-Gerüst ist linear mit einem kurzen C≡N-Abstand von 1,16 Å. - Acetonitril wurde erstmals 1847 von dem französischen Chemiker Jean-Baptiste Dumas hergestellt. - Anwendungen - Acetonitril wird hauptsächlich als Lösungsmittel bei der Reinigung von Butadien in Raffinerien verwendet. Konkret wird Acetonitril in den oberen Teil einer Destillationskolonne eingespeist, die mit Kohlenwasserstoffen einschließlich Butadien gefüllt ist. Wenn das Acetonitril durch die Kolonne nach unten fällt, absorbiert es das Butadien, das dann vom Boden des Turms in einen zweiten Abscheideturm geleitet wird. In diesem wird das Butadien durch Wärmezufuhr abgetrennt. - Im Labor wird Butadien als mittelpolares Lösungsmittel verwendet, das mit Wasser und einer Reihe von organischen Lösungsmitteln mischbar ist, jedoch nicht mit gesättigten Kohlenwasserstoffen. Es hat eine angenehme Flüssigkeitsreichweite und eine hohe Dielektrizitätskonstante von 38,8. Mit einem Dipolmoment von 3,92 D löst Acetonitril eine breite Palette ionischer und unpolarer Verbindungen und eignet sich als mobile Phase in der HPLC und LC-MS. - Aufgrund seiner relativ hohen Dielektrizitätskonstante und seiner Fähigkeit, Elektrolyte aufzulösen, wird es häufig in Batterieanwendungen eingesetzt. Aus ähnlichen Gründen ist es ein beliebtes Lösungsmittel in der zyklischen Voltammetrie. - Seine Transparenz im ultravioletten Bereich (UV-Cutoff), seine niedrige Viskosität und seine geringe chemische Reaktivität machen es zu einer beliebten Wahl für die Hochleistungsflüssigkeitschromatographie (HPLC). - Acetonitril spielt eine wichtige Rolle als wichtigstes Lösungsmittel bei der Oligonukleotidsynthese aus Nukleosidphosphoramiditen. - In der Industrie wird es als Lösungsmittel für die Herstellung von Arzneimitteln und fotografischen Filmen verwendet. - Organische Synthese - Acetonitril ist ein gebräuchlicher Zweikohlenstoff-Baustein in der organischen Synthese vieler nützlicher Chemikalien, darunter Acetamidinhydrochlorid, Thiamin und α-Naphthalinessigsäure. Bei der Reaktion mit Chlorcyan entsteht Malononitril. - Als Elektronenpaar-Donator - Acetonitril besitzt ein freies Elektronenpaar am Stickstoffatom, das zahlreiche Übergangsmetall-Nitrilkomplexe bilden kann. Da es schwach basisch ist, ist es ein leicht verdrängbarer Ligand. So wird beispielsweise Bis(acetonitril)palladiumdichlorid durch Erhitzen einer Suspension von Palladiumchlorid in Acetonitril hergestellt: - Ein verwandter Komplex ist Tetrakis(acetonitril)kupfer(I)hexafluorophosphat [Cu(CH3CN)4]+. Die CH3CN-Gruppen in diesen Komplexen werden schnell von vielen anderen Liganden verdrängt. - Es bildet auch Lewis-Addukte mit Lewis-Säuren der Gruppe 13 wie Bortrifluorid. In Supersäuren ist es möglich, Acetonitril zu protonieren. - Herstellung - Acetonitril ist ein Nebenprodukt bei der Herstellung von Acrylnitril. Der größte Teil wird zur Unterstützung des vorgesehenen Prozesses verbrannt, aber schätzungsweise mehrere tausend Tonnen werden für die oben genannten Anwendungen zurückbehalten. Die Produktionstrends für Acetonitril folgen daher im Allgemeinen denen von Acrylnitril. Acetonitril kann auch durch viele andere Verfahren hergestellt werden, die jedoch seit 2002 keine kommerzielle Bedeutung mehr haben. Beispiele hierfür sind die Dehydratisierung von Acetamid oder die Hydrierung von Gemischen aus Kohlenmonoxid und Ammoniak. Im Jahr 1992 wurden in den USA 14.700 Tonnen (32.400.000 lb) Acetonitril hergestellt. - Auch die katalytische Ammoxidation von Ethylen wurde erforscht. - Acetonitril-Knappheit in den Jahren 2008-2009 - Ab Oktober 2008 war das weltweite Angebot an Acetonitril gering, da die chinesische Produktion wegen der Olympischen Spiele eingestellt wurde. Außerdem wurde eine US-amerikanische Fabrik in Texas durch den Hurrikan Ike beschädigt. Aufgrund der weltweiten Konjunkturabschwächung ging die Produktion von Acrylnitril, das in Acrylfasern und Acrylnitril-Butadien-Styrol-Harzen (ABS) verwendet wird, zurück. Acetonitril ist ein Nebenprodukt bei der Herstellung von Acrylnitril, dessen Produktion ebenfalls zurückging, was die Acetonitril-Knappheit weiter verschärfte. Die weltweite Verknappung von Acetonitril hielt bis Anfang 2009 an. - Sicherheit - Toxizität - Acetonitril ist in geringen Dosen nur mäßig toxisch.[11][20] Es kann zu Blausäure metabolisiert werden, die die Quelle der beobachteten toxischen Wirkungen ist. - Im Allgemeinen treten die toxischen Wirkungen erst verzögert ein, da der Körper Zeit benötigt, um Acetonitril in Cyanid umzuwandeln (im Allgemeinen etwa 2-12 Stunden). - Fälle von Acetonitrilvergiftungen beim Menschen (oder genauer gesagt von Cyanidvergiftungen nach Exposition gegenüber Acetonitril) sind selten, aber nicht unbekannt, und zwar durch Einatmen, Verschlucken und (möglicherweise) durch Hautresorption. Zu den Symptomen, die in der Regel erst mehrere Stunden nach der Exposition auftreten, gehören Atembeschwerden, langsamer Pulsschlag, Übelkeit und Erbrechen. In schweren Fällen können Krämpfe und Koma auftreten, gefolgt vom Tod durch Atemstillstand. Die Behandlung erfolgt wie bei einer Zyanidvergiftung, wobei Sauerstoff, Natriumnitrit und Natriumthiosulfat zu den am häufigsten verwendeten Notfallbehandlungen gehören. - Trotz seiner Toxizität wurde es in Formulierungen für Nagellackentferner verwendet. Mindestens zwei Fälle von versehentlicher Vergiftung von Kleinkindern durch Nagellackentferner auf Acetonitrilbasis wurden gemeldet, von denen einer tödlich verlief. Aceton und Ethylacetat werden für den Hausgebrauch oft als sicherer bevorzugt, und Acetonitril ist seit März 2000 in kosmetischen Mitteln im Europäischen Wirtschaftsraum verboten. - Metabolismus und Ausscheidung - Wie andere Nitrile kann auch Acetonitril in Mikrosomen, insbesondere in der Leber, zu Blausäure metabolisiert werden, wie Pozzani et al. 1959 erstmals zeigten. Der erste Schritt in diesem Stoffwechselweg ist die Oxidation von Acetonitril zu Glycolonitril durch eine NADPH-abhängige Cytochrom P450-Monooxygenase. Das Glycolonitril zersetzt sich dann spontan zu Blausäure und Formaldehyd. Formaldehyd, das an sich schon ein Toxin und ein Karzinogen ist, wird weiter zu Ameisensäure oxidiert, die eine weitere Quelle der Toxizität darstellt. - Der Metabolismus von Acetonitril ist viel langsamer als der anderer Nitrile, was seine relativ geringe Toxizität erklärt. So war eine Stunde nach Verabreichung einer potenziell tödlichen Dosis die Cyanidkonzentration im Rattenhirn 1⁄20 so hoch wie bei einer 60-mal geringeren Propionitrildosis. - Der relativ langsame Metabolismus von Acetonitril zu Cyanwasserstoff ermöglicht es, dass ein größerer Teil des produzierten Cyanids im Körper zu Thiocyanat entgiftet wird (Rhodanese-Weg). Dadurch kann auch ein größerer Teil des Acetonitrils unverändert ausgeschieden werden, bevor es verstoffwechselt wird. Die wichtigsten Ausscheidungswege sind die Ausatmung und der Urin.
FAQs
Wie lautet die CAS-Nummer von Acetonitril?
Die CAS-Nummer von Acetonitril ist 75-05-8.CAS Acetonitril?
Die CAS-Nummer von Acetonitril ist 75-05-8. CAS 75-05-8?
Die CAS-Nummer 75-05-8 ist dem Acetonitril zugeordnet.Was ist Acetonitril?
Acetonitril ist ein polares organisches Lösungsmittel mit der Formel CH3CN. Es ist das organische Nitril mit der einfachsten möglichen Struktur. Das Stickstoffatom des Moleküls enthält zwei ungepaarte Elektronen, die ihm seine Reaktivität und Stabilität verleihen. Es ist eine farblose Flüssigkeit, die weit verbreitet ist, weil sie mit Wasser und einer Vielzahl von organischen Lösungsmitteln, mit Ausnahme von gesättigten Kohlenwasserstoffen (Erdölfraktionen), mischbar ist, einen niedrigen Schmelzpunkt und eine geringe Absorption im nahen ultravioletten Spektrum (200 nm - 400 nm) aufweist. Aus diesem Grund gibt es zahlreiche und vielfältige Anwendungen. Acetonitril ist auch als Methylcyanid, Cyanomethan oder Ethannitril bekannt. Wozu wird Acetonitril verwendet?
Die Anwendungen von Acetonitril sind vielfältig: Lösungsmittel für die Butadienextraktion; chemisches Zwischenprodukt für die Herstellung von Pestiziden wie Acetamiprid; Lösungsmittel für organische und anorganische Verbindungen. Es wird auch als Rohstoff für die Herstellung von Acetophenon, Thiamin, Acetamidin usw. verwendet; für die Extraktion von Teeren, Phenolen und Farbstoffen in Erdölkohlenwasserstoffen (da letztere in Acetonitril unlöslich sind); bei der Herstellung von Acrylfasern, Arzneimitteln, Nitrilkautschuk, ABS-Harzen usw. In der organischen Synthese wird es als aprotisches polares Lösungsmittel für die Herstellung von Arzneimitteln, Zwischenprodukten, Oligonukleotiden und Peptiden verwendet. Für analytische Bestimmungen ist hochreines Acetonitril ein weit verbreitetes Lösungsmittel, das sich besonders für chromatographische Techniken eignet. In den letzten Jahren hat der Einsatz der Ultra-Hochleistungs-Flüssigkeitschromatographie (UHPLC) erheblich zugenommen. Die zunehmende Geschwindigkeit der Analyse, die hohe Effizienz, die hohe Auflösung, die Robustheit, die Zuverlässigkeit und die kommerzielle Verfügbarkeit einer breiten Palette von UHPLC-Geräten und stationären Phasen sowie erhebliche Verbesserungen in der Technologie dieser Geräte (Detektoren, automatische Injektoren, Pumpen, Säulen usw.) haben dazu geführt, dass immer mehr Labors UHPLC-Geräte anschaffen und Methoden für die Analyse von z. B. Arzneimitteln mit dieser Technik entwickeln. Um die maximale Leistung dieser UHPLC-Systeme zu erreichen, wird die Verwendung geeigneter Lösungsmittel hoher Reinheit empfohlen, um die Nachweisempfindlichkeit zu erhöhen, die Quantifizierungsgenauigkeit zu verbessern und die UHPLC-Systeme vor partikulären Verunreinigungen zu schützen, die das System verstopfen und blockieren können. Acetonitril wird auch in der Flüssigkeitschromatographie/Massenspektrometrie (LC/MS) verwendet, z. B. für die Peptid- und Proteinanalyse, für die Spektroskopie, die Analyse von Pestizidrückständen, die DNA-Synthese usw. Welche Anwendungen hat Acetonitril?
Die Anwendungen von Acetonitril sind vielfältig: Lösungsmittel für die Butadienextraktion; chemisches Zwischenprodukt für die Herstellung von Pestiziden wie Acetamiprid; Lösungsmittel für organische und anorganische Verbindungen. Es wird auch als Rohstoff für die Herstellung von Acetophenon, Thiamin, Acetamidin usw. verwendet; für die Extraktion von Teeren, Phenolen und Farbstoffen in Erdölkohlenwasserstoffen (da letztere in Acetonitril unlöslich sind); bei der Herstellung von Acrylfasern, Arzneimitteln, Nitrilkautschuk, ABS-Harzen usw. In der organischen Synthese wird es als aprotisches polares Lösungsmittel für die Herstellung von Arzneimitteln, Zwischenprodukten, Oligonukleotiden und Peptiden verwendet. Für analytische Bestimmungen ist hochreines Acetonitril ein weit verbreitetes Lösungsmittel, das sich besonders für chromatographische Techniken eignet. In den letzten Jahren hat der Einsatz der Ultra-Hochleistungs-Flüssigkeitschromatographie (UHPLC) erheblich zugenommen. Die zunehmende Geschwindigkeit der Analyse, die hohe Effizienz, die hohe Auflösung, die Robustheit, die Zuverlässigkeit und die kommerzielle Verfügbarkeit einer breiten Palette von UHPLC-Geräten und stationären Phasen sowie die erheblichen Verbesserungen in der Technologie dieser Geräte (Detektoren, automatische Injektoren, Pumpen, Säulen usw.) haben dazu geführt, dass immer mehr Labors UHPLC-Geräte anschaffen und Methoden für die Analyse von beispielsweise Arzneimitteln mit dieser Technik entwickeln. Um die maximale Leistung dieser UHPLC-Systeme zu erreichen, wird die Verwendung geeigneter Lösungsmittel hoher Reinheit empfohlen, um die Nachweisempfindlichkeit zu erhöhen, die Quantifizierungsgenauigkeit zu verbessern und die UHPLC-Systeme vor partikulären Verunreinigungen zu schützen, die das System verstopfen und blockieren können. Acetonitril wird auch in der Flüssigkeitschromatographie/Massenspektrometrie (LC/MS) verwendet, z. B. für die Peptid- und Proteinanalyse, für die Spektroskopie, die Analyse von Pestizidrückständen, die DNA-Synthese usw. Was ist der Schmelzpunkt von Acetonitril?
Der Schmelzpunkt (Gefrierpunkt) von Acetonitril liegt bei -45 °C. Wie hoch ist der Siedepunkt von Acetonitril?
Der Siedepunkt von Acetonitril liegt bei 82 °C. Was ist die Löslichkeit von Acetonitril?
Acetonitril ist mischbar mit Methanol, Ethanol, Isopropanol, Methylacetat, Ethylacetat, Ether, Acetamidlösungen, Chloroform, Tetrachlorkohlenstoff, Ethylenchlorid und mit vielen ungesättigten Kohlenwasserstoffen; nicht mischbar mit vielen gesättigten Kohlenwasserstoffen (Erdölfraktionen). Wie hoch ist die Dichte von Acetonitril?
Die Dichte von Acetonitril beträgt 0,786 g/ml bei 25 °C.Wie hoch ist das Dipolmoment von Acetonitril?
Das Dipolmoment von Acetonitril beträgt 3,92 D. Wie hoch ist die Dielektrizitätskonstante von Acetonitril?
Die Dielektrizitätskonstante (Permittivität) von Acetonitril beträgt 37,5 bei 20 °C. Welche Sicherheitshinweise gibt es für Acetonitril?
Die Sicherheitshinweise für Acetonitril gemäß der CLP-Verordnung (Classification, Labelling and Packaging) sind: H225, H302+H312+H332, H319; P210, P280, P303+P361+P353, P305+P351+P338, P403+P235, P501. Die Symbole oder Piktogramme nach GHS (Global Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien) sind: GHS02 und GHS07. Acetonitril ist nur für den professionellen Gebrauch bestimmt. Das Sicherheitsdatenblatt (SDS) kann unter folgendem Link eingesehen werden: https://www.itwreagents.com/download_file/sds/221881/eu/sds_221881_en.pdf. Wo kann man Acetonitril kaufen?
Sie können Acetonitril der Marke PanReac AppliChem von ITW Reagents über sein weltweites Händlernetz oder über den Online-Shop kaufen, wenn Sie ein registrierter Kunde von ITW Reagents sind. Folgen Sie diesem Link, um einen Händler in Ihrem Land zu finden https://www.itwreagents.com/rest-of-world/en/distributors-rw. Wenn Sie Acetonitril für Produktionsprozesse kaufen möchten, wenden Sie sich bitte direkt an uns.