Dimensioni confezioni (1)
| codice | dimensione imballaggio | prezzo per unità | prezzo confezione per unità | |
|---|---|---|---|---|
| Codice e imballaggio | Prezzo per articolo | |||

|
codice
121076.1211
|
dimensione imballaggio
1000 ml
|
prezzo per unità
unico
53,80€
|
prezzo confezione per unità
45,73€x 6 unità
|
Dati tecnici
- Melting Point:
- -26 °C
- Boiling Point:
- 107 °C
- Density:
- 1.10 kg/l
- Physical Description:
- liquid
- Product Code:
- 121076
- Product Name:
- Hydrogen Peroxide 30% w/v (100 vol.) for analysis
- Quality Name:
- for analysis
- Specifications:
- Minimum assay (Perm.) w/v: 30.0%
Assay (in vol. O2) (Perm.): 100 vol.
Maximum limit of impurities
APHA colour: 10
Acidity: 0.0008 meq/g
Non-volatile matter: 0.005 %
Chloride (Cl): 0.0001%
Nitrogen compounds (as N): 0.001%
Phosphate (PO4): 0.0005 %
Sulfate (SO4): 0.0005%
Heavy metals (as Pb): 0.0001%
Metals by ICP [in mg/Kg (ppm)]
Ag: 0.05
Al: 0.2
As: 0.5
Au: 0.1
B: 0.5
Ba: 0.1
Be: 0.02
Bi: 0.05
Ca: 0.5
Cd: 0.05
Co: 0.02
Cr: 0.02
Cu: 0.02
Fe: 0.1
Ga: 0.05
Ge: 0.05
Hg: 0.1
In: 0.05
K: 5
Li: 0.02
Mg: 0.1
Mn: 0.02
Mo: 0.02
Na: 10
Ni: 0.05
Pb: 0.1
Pt: 0.1
Sb: 0.02
Sr: 0.02
Ti: 0.05
Tl: 0.02
V: 0.02
Zn: 0.1
Zr: 0.05
- Pittogrammi di pericolo
-
- UN:
- 2014
- Class/PG:
- 5.1(8)/II
- ADR:
- 5.1(8)/II
- IMDG:
- 5.1(8)/II
- IATA:
- 5.1(8)/II
- WGK:
- 1
- Storage:
- Room Temperature.
- Signal Word:
- Danger
- GHS Symbols:
- GHS07
GHS05
- H Phrases:
- H302
H318
H332
- P Phrases:
- P264
P270
P280
P301+P312
P305+P351+P338
P310
P330
P501
- Master Name:
- Hydrogen Peroxide 30% w/v *(100 vol)
- Synonyms Long Text:
- Hydrogen Dioxide, Hydroperoxide
- EINECS:
- 231-765-0
- CS:
- 28470000
- Index Nr.:
- 008-003-00-9
Documenti
Richieste
Comments
Il perossido di idrogeno (H2O2), noto anche come perossido di idrogeno, diossogeno, diossidano o perossido di diidrogeno, è un composto chimico con le caratteristiche di un liquido altamente polare e fortemente legato all'idrogeno, come l'acqua, solitamente di aspetto liquido leggermente più viscoso. È noto per essere un potente ossidante.A temperatura ambiente è un liquido incolore con un odore pungente e sgradevole. Piccole quantità di perossido di idrogeno gassoso sono presenti naturalmente nell'aria. Il perossido di idrogeno è molto instabile. Si decompone lentamente in ossigeno e acqua, rilasciando una grande quantità di calore. La velocità di decomposizione può essere notevolmente aumentata in presenza di catalizzatori.
Sebbene non sia infiammabile, è un potente agente ossidante che, quando entra in contatto con la materia organica o con alcuni metalli come il rame, l'argento o il bronzo, può provocare una combustione spontanea.
Il perossido di idrogeno si trova in basse concentrazioni (dal 3 al 9%) in molti prodotti per la casa per uso medicinale e come sbiancante per abiti e capelli. Nell'industria viene utilizzato in concentrazioni più elevate, per sbiancare i tessuti e la pasta di carta, e al 90% come componente dei combustibili per razzi e per la produzione di gommapiuma e prodotti chimici organici. In altri settori, come la ricerca, viene utilizzato per misurare l'attività di alcuni enzimi, come la catalasi.
Proprietà fisiche e chimiche
Il perossido di idrogeno puro (H2O2) è un liquido denso e limpido, con una densità di 1,47 g/cm³ a 0 °C. Il suo punto di fusione è -0,5 g/cm³. Il suo punto di fusione è di -0,4 °C. Il suo punto di ebollizione normale è 150 °C.
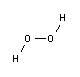
Stereochimica
Come l'acqua, il perossido di idrogeno ha un asse di simmetria (asse ruotato di 180°). Ha tre conformazioni: cis-planare (gruppo di simmetria C2v), cis-non-planare (gruppo di simmetria C2) e trans-planare (gruppo di simmetria C2h).
Reattività
Il perossido di idrogeno concentrato è una sostanza pericolosamente reattiva, perché la sua decomposizione per generare acqua e ossigeno è altamente esotermica. La seguente reazione termochimica dimostra questo fatto:
2 H2O2 (l) → 2 H2O (l) + O2 (g) ΔHº = -98,2 kJ/mol.
Impegnato come agente ossidante e riducente.
Il perossido di idrogeno è in grado di agire sia come agente ossidante sia come agente riducente. Le equazioni seguenti presentano le semireazioni in ambiente acido:
2 H+ (aq) + H2O2 (aq) + 2 e- → 2 H2O (l) Eo - netto = 1,77 V
O2 (g) + 2 H+ + 2 e- → H2O2 (aq) Eo - reticolo = 0,695 V2
In soluzione basica, i potenziali corrispondenti all'elettrodo standard sono 0,87 V (volt̠) per la riduzione del perossido di idrogeno e 0,08 V per la sua ossidazione.
La produzione
In passato il perossido di idrogeno veniva preparato mediante elettrolisi di una soluzione acquosa di acido solforico o di bisolfato di ammonio acido (NH4HSO4), seguita dall'idrolisi del perossidosolfato ((SO4)2). Il perossido di idrogeno si ottiene oggi quasi esclusivamente per autossidazione di un 2-alchossi-antraidrochinone (o 2-alcho-9-10-diidrossi-antracene) al corrispondente 2-alchoantrachinone in un metodo chiamato "processo dell'antrachinone".
Nel 1994, la produzione mondiale di H2O2 era di 1,9 milioni di tonnellate. Nel 2006 è salita a 2,2 milioni, la maggior parte con una concentrazione del 70% o inferiore. In quell'anno, un chilogrammo di perossido di idrogeno veniva venduto a 1,5 dollari.
Scoperta
Il perossido di idrogeno fu descritto per la prima volta nel 1818 da Louis Jacques Thénard, che lo produsse trattando il perossido di bario con acido nitrico. Una versione migliorata di questo processo utilizza l'acido cloridrico, seguito dall'aggiunta di acido solforico per far precipitare il sottoprodotto solfato di bario. Il processo Thénard è stato utilizzato dalla fine del XIX secolo fino alla metà del XX secolo.
A lungo si è ritenuto che il perossido di idrogeno puro fosse instabile, poiché tutti i primi tentativi di separarlo dall'acqua, presente durante la sintesi, sono falliti. Questa instabilità era dovuta a tracce di impurità (sali di metalli di transizione), che catalizzano la decomposizione del perossido. Il perossido di idrogeno puro fu ottenuto per la prima volta nel 1894 - quasi 80 anni dopo la sua scoperta - da Richard Wolffenstein, che lo produsse per distillazione sotto vuoto.
La determinazione della struttura molecolare del perossido di idrogeno era molto difficile. Nel 1892, il fisico-chimico italiano Giacomo Carrara (1864-1925) ne determinò la massa molecolare mediante discesa crioscopica, che confermò la formula molecolare H2O2. Almeno una mezza dozzina di ipotetiche strutture molecolari apparivano coerenti con le prove disponibili. Nel 1934, il fisico matematico inglese William Penney e il fisico scozzese Gordon Sutherland proposero una struttura molecolare molto simile a quella oggi accettata.
Applicazioni
Industriale
Il perossido di idrogeno ha molti usi industriali, come ad esempio:
- Sbiancamento di tessuti, cotone e pasta di carta.
- È sempre più utilizzato come sostituto del cloro.
- Nell'industria alimentare è ampiamente utilizzato per sbiancare formaggio, pollo, carne, ossa e per la produzione di oli vegetali.
- Nell'industria chimica è utilizzato come reagente.
- È molto importante nella produzione di prodotti farmaceutici.
- Viene utilizzato anche per lo sbiancamento dentale. Il perossido di idrogeno industriale ha solitamente concentrazioni superiori al 30%, a differenza di quello per uso domestico acquistato in farmacia e nei supermercati, che di solito contiene solo il 3%.
Aerospaziale
Il perossido di idrogeno è utilizzato nell'industria aerospaziale come combustibile nei motori a razzo monopropellente o per l'apporto di ossigeno nei motori bipropellenti. Questo perossido viene generalmente utilizzato a una concentrazione del 90%. È estremamente esplosivo.
Artistico
Il perossido di idrogeno viene utilizzato nei lavori di restauro. In molti dipinti antichi, i pigmenti bianchi a base di carbonato di piombo(II) si sono scoloriti a causa della formazione di solfuro di piombo(II), particolarmente nero. Il perossido di idrogeno reagisce in modo tale da convertire il solfuro di piombo(II) in solfato di piombo(II) (colore bianco). Entrambi i sali sono insolubili in acqua. La reazione avviene come mostrato nella seguente equazione.
PbS (s) + 4 H2O2 (aq) → PbSO4 (s) + 4 H2O (l)
Uso terapeutico
In generale, le principali agenzie sanitarie di tutto il mondo riconoscono il perossido di idrogeno a diluizioni fino al 6% come sicuro per l'uso come agente antimicrobico, ossidante e per altri scopi. Grazie al suo effetto ossidante, è stato utilizzato per molti anni come agente antisettico e antibatterico. Il suo uso è diminuito negli ultimi anni a causa della popolarità di altri prodotti sostitutivi. È ancora utilizzato in molti ospedali, centri medici e cliniche.
Disinfezione
Il perossido di idrogeno è un antisettico generale. Il suo meccanismo d'azione è dovuto ai suoi effetti ossidanti: produce idrossile (OH-) e radicali liberi che attaccano un'ampia varietà di composti organici, compresi i lipidi e le proteine che costituiscono le membrane cellulari dei microrganismi. L'enzima catalasi presente nei tessuti degrada rapidamente il perossido di idrogeno, producendo ossigeno, che ostacola la germinazione delle spore anaerobiche.
Viene utilizzato nelle dermoapplicazioni, nella pulizia delle protesi e nella disinfezione orale, nonché, nel campo dell'ottica, nella disinfezione delle lenti a contatto.
Inoltre, sfruttando l'attività della perossidasi presente nel sangue, viene utilizzato insieme alla fenolftaleina per rilevare la presenza di sangue (test di Kastle-Meyer).
Sinonimi di perossido di idrogeno: Diossido; Ossidanile; Acido peridrossico; 0-idrossiolo; Biossido di diidrogeno; Acqua ossigenata; Peroxaan
FAQs
Quali sono i sinonimi di Perossido di Idrogeno?
I sinonimi di Perossido di Idrogeno sono Diossidano, Ossidanile; Acido Peridrossico; 0-Idrossiolo, Diossido di Diidrogeno, Acqua Ossigenata, Peroxaan e H2O2.Qual è il numero CAS del perossido di idrogeno?
Il numero CAS del perossido di idrogeno è 7722-84-1.
Perossido di idrogeno CAS?
Il numero CAS del perossido di idrogeno è 7722-84-1.
CAS 7722-84-1?
Il numero CAS 7722-84-1 è assegnato al perossido di idrogeno.



